甲壳动物的免疫机制
同其它无脊椎动物一样,甲壳动物缺乏特异性免疫应答,只能依靠先天性免疫应答抵御病原微生物的感染。甲壳动物先天性免疫应答机制主要由血淋巴细胞以及存在或释放到血浆中的多种体液免疫因子来完成。即当外来病原微生物入侵时,机体首先要依靠其特有的模式识别蛋白(pattern recognition proteins,PRPs)识别病原微生物,然后将信息传递给血淋巴细胞,一方面促使血淋巴细胞发挥吞噬作用和包掩作用,另一方面促使血淋巴细胞合成体液免疫因子并利用这些免疫因子杀死和清除外来病原微生物,达到免疫保护的目的(见图)。此外,甲壳动物的屏障结构也发挥着一定的免疫防御作用。
1 屏障结构
坚硬的甲壳是甲壳动物防御体系的第一道屏障。除了起到机械阻挡作用之外,甲壳和表皮上还存在一些免疫因子和正常菌群发挥着免疫作用。如当病原真菌侵入甲壳动物表皮时,可见黑色素环绕着真菌菌丝以抑制其进一步蔓延扩散。又如虾类的表皮中含有蛋白酶抑制剂,可抑制病原菌分泌的毒性胞外蛋白酶的作用,阻碍其穿透体表。存在于甲壳动物表皮上的正常菌群也可以阻止或拮抗外来病原微生物的定居与繁殖。当表皮损伤而被穿透时,上皮细胞则分泌一种“损伤因子”而引发表皮下细胞局部簇集,发生凝固作用以封闭伤口。此外,虾类蜕皮行为也是排除体内异物的最有效方式。
2 细胞免疫
甲壳动物的血淋巴细胞既是细胞免疫应答的承担者,也是体液免疫因子的提供者。当病原微生物突破机体第一道防御屏障进入血淋巴后,则刺激体内血淋巴细胞发生一系列的细胞免疫应答。首先,血淋巴细胞通过吞噬、包囊、形成结节等防御反应清除血窦中入侵的病原微生物,其次它们通过释放胞浆凝结因子参与伤口的愈合。此外,血淋巴细胞还参与合成一些重要的体液免疫因子。
(1)吞噬作用
吞噬作用在动物界普遍存在,低等单细胞动物通过吞噬作用摄取食物,高等多细胞动物的吞噬作用则是吞噬消化和清除一切异物的重要手段。目前己证实甲壳动物的血淋巴细胞具有吞噬异物能力,其吞噬过程是血淋巴细胞首先接触异物,通过辨别其表面特征结构识别异物;然后在粘附分子作用下血淋巴细胞与异物粘附,相互凝集形成细胞团;最后血淋巴细胞伸出伪足或直接形成凹陷将异物吞入形成吞噬泡,细胞内溶酶体释放水解酶或产生活性氧对异物进行杀死、消化和清除。与此同时,常常伴随着血细胞解体。
甲壳动物的粘附分子粘附分子是由细胞产生,存在于细胞表面或细胞外基质中,通过存在于细胞或细胞间基质上的配体使细胞与细胞间,或细胞与基质间相互结合的一类分子。根据粘附分子的结构特点不同,脊椎动物体内的粘附分子分为整合素家族、选择素家族、钙粘蛋白家族和免疫球蛋白家族四类。在蝲蛄、斑节对虾、螯虾、小龙虾和岸蟹等多种甲壳动物中也发现了一些粘附分子,主要是整合蛋白和过氧化物酶家族的Peroxinectin分子。Peroxinectin分子最初是由Johansson 和 Soderhall(1988)从软尾太平蝲蛄血细胞分泌物中分离纯化获得,经cDNA克隆及序列分析表明,此蛋白与其它动物体内的过氧化物酶家族中蛋白质极其相似,相对分子量约为76kDa,在蛋白质羧基末端含有粘附因子特有的KGD基序。因此,Peroxinectin粘附因子既具有粘附活性,又具有过氧化物酶活性。斑节对虾中的peroxinectin基因也已被克隆,其与软尾太平蝲蛄peroxi-nectin编码基因的同源性为60%,与脊椎动物peroxinectin编码基因的同源性为45%~55%。整合蛋白是一跨膜二聚体蛋白,它是许多胞外粘附配体的受体,配体蛋白多种多样,分属于不同蛋白家族,如胶原蛋白、纤粘连蛋白等,但其共同特征是具有RGD基序,借此可被整合素识别。Peroxinectin粘附分子中也含有整合蛋白结合识别位点,可与之结合。
在甲壳动物血淋巴细胞粘附病原微生物的过程中,上述两种粘附分子共同发挥作用。粘附分子由血淋巴细胞产生后,以无活性形式储存于分泌性颗粒中,受到病原微生物刺激后被激活并释放到细胞表面或胞外基质中,首先是整合蛋白与病原微生物靶蛋白上特定基序结合,然后Peroxinectin粘附分子再与整合蛋白结合,引起细胞内的信号传递,触发细胞吞噬、杀死、消化和清除病原微生物。
血淋巴细胞的杀菌机制血细胞吞入病原微生物后可通过氧化性杀菌机制和非氧化性杀菌机制杀死病原微生物。氧化性杀菌现象最初是在哺乳动物的嗜中性白细胞和巨噬细胞中发现,又称为呼吸爆发。Bell等证实了甲壳动物血淋巴细胞也存在氧化性杀菌现象,其机制是血淋巴细胞吞噬病原微生物后,细胞膜上的NADPH氧化酶催化氧还原形成超氧阴离子,随后再活化为各种活性氧或氧化物,如过氧化氢、羟自由基和单线态氧等。ROS或ROIs直接作用于微生物,或通过髓过氧化物酶和卤化物的协同作用而杀死病原微生物。
非氧化性杀菌机制主要以溶酶体酶的水解作用来杀死病原微生物。溶酶体酶一般包括溶菌酶、过氧化物酶及各种水解酶类,如蛋白酶、肽酶、磷酸酶、脂酶和糖酵解酶等。吞噬细胞对外来异物进行吞噬或包囊后,细胞内的溶酶体与异物进行融合形成吞噬溶酶体,并释放各种酶类,其中溶菌酶、过氧化物酶、磷酸酶等直接杀死外来入侵的病原微生物,随后各种水解性酶类再进一步将它们水解消化并将消化后的的残渣碎片排出胞外。
(2)形成结节和包囊作用
当大量异物进入机体后,吞噬细胞难以完全吞噬和清除异物,这时血细胞形成层状结节结构将异物包围而与机体隔离开来,最终结节发生黑色素化。所谓包囊化就是当异物(如真菌、寄生虫等)的体积大于吞噬细胞时,血细胞与其它细胞联合将异物包围起来,形成类似于包囊的结构,将异物与机体隔离的现象。对包囊和结节进行超微结构和组织化学观察,发现形成包囊和结节中的血细胞失去游离状态并相互连接,细胞器趋于退化,RNA和色氨酸含量明显减少,在包囊和结节中均能检测到较多量的黑色素,黑色素一方面能够隔离病原微生物,避免它们与宿主接触,另一方面对真菌或寄生虫等病原微生物具有抑制或杀死作用。
(3)伤口修复作用
血淋巴细胞在甲壳动物的伤口修复过程中也起着十分重要的作用,其机制同人类的伤口修复过程基本相似,主要包括以下几个阶段:①血淋巴细胞浸润;②血淋巴细胞对异物或坏死组织的包囊;③纤维细胞使胶原纤维沉积;④血淋巴细胞对异物或坏死组织的吞噬;⑤上皮细胞迁移到伤口,形成新表皮。
3 体液免疫
甲壳动物缺乏免疫球蛋白,体液免疫主要依靠血淋巴中天然形成的或诱导产生的各种免疫因子,如模式识别蛋白、凝集素、酚氧化酶原系统、溶血素、抗菌肽、热休克蛋白免疫因子等来完成。这些体液免疫因子相互协同,参与识别异物,免疫调理以及促进血淋巴细胞的吞噬、包囊和细胞毒性等作用,最终杀灭和清除病原微生物。
(1)模式识别蛋白(Pattern recognition proteins,PRPs)
病原微生物(抗原)侵入到体内,刺激机体发生免疫应答的第一步是机体对病原微生物(抗原)进行识别。在脊椎动物中可通过抗体、T淋巴细胞和补体途径识别抗原表位而启动免疫应答。对于缺乏抗体和T淋巴细胞的甲壳动物来说,则是通过血淋巴中的模式识别蛋白来识别或结合微生物表面保守的病原体相关分子模式(Pathogen associated molecular patterns,PAMPs),如革兰氏阴性菌细胞壁脂多糖、革兰氏阳性菌细胞壁肽聚糖、真菌细胞壁甘露糖和β-1,3-葡聚糖以及RNA病毒的双链RNA等。PRPs识别抗原后,通过激活血淋巴中的蛋白酶或通过组织细胞内信号传导途径而启动免疫应答。PRRs也是一种调理素,调理血细胞的吞噬作用。目前从甲壳类动物中纯化或克隆的模式识别蛋白主要有β-1,3-葡聚糖结合蛋白(βGBP)、脂多糖结合蛋白(LBP)、葡聚糖和脂多糖结合蛋白(LGBP),其中一些模式识别蛋白(如LBP)也是外源性凝集素,可直接作为凝集素或调理素发挥作用。甲壳类动物模式识别蛋白的来源、分子大小和作用总结见表2。
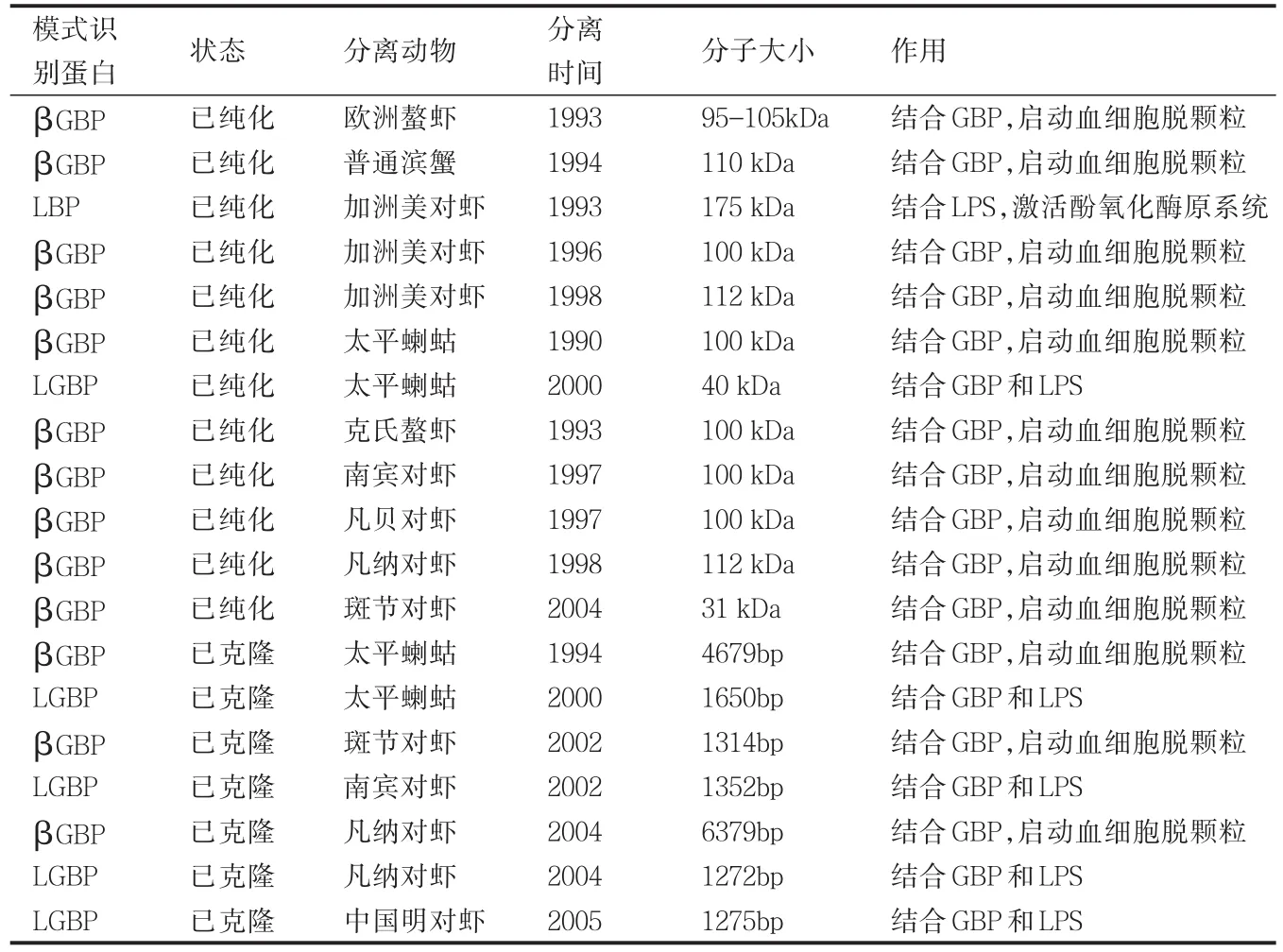
表1 甲壳动物中纯化或克隆的模式识别蛋白
(2)酚氧化酶原系统(Prophenoloaidase system,proPOS)
酚氧化酶原系统是甲壳动物体内最重要的免疫识别和防御系统,它是一个类似于脊椎动物补体系统的复杂酶级联系统。从软尾太平蝲蛄中鉴定出的该系统成员有:酚氧化酶原(prophenoloxidase,proPO)、酚氧化酶原激活酶(prophenoloxidase activating enzyme,ppA)、ß-1,3-葡聚糖结合蛋白及其膜受体和酚氧化酶原抑制蛋白(蛋白酶抑制剂、α 2-巨球蛋白)。目前已经有5种甲壳动物的酚氧化酶原基因被克隆测序,序列分析表明酚氧化酶原是一条由688个氨基酸组成的多肽链,氨基酸序列中有2个铜结合位点,此位点周围的序列高度保守,酶原激活的切割位点在Arg44和Va145之间,脊椎动物补体分子中常见的激活酶切割位点硫醇酯基序(GCGEQNM)在proPO中也有发现。酚氧化酶原激活酶是一种内源性丝氨酸蛋白酶,它通过蛋白水解作用可将proPO裂解为具有活性的酚氧化酶(phenoloxidase,PO)。ß-1,3-葡聚糖结合蛋白本身不具任何酶活性,但与ß-葡聚糖结合后,可通过增强酚氧化酶原激活酶的活性从而激活酚氧化酶。酚氧化酶原抑制蛋白的存在,可避免酚氧化酶原激活系统自发释放对机体造成的损伤,从而起到自我保护作用。
在正常情况下,酚氧化酶原系统中各成分是以无活性的酶原形式存在于血细胞颗粒中,只有在微量的激活剂作用下,进行一系列的酶促反应,各成分才依次被活化并释放到血淋巴中。这些酶促反应的基本规律是第一个反应的产物催化第二个反应,第二个反应的产物催化第三个反应,依次类推。这种连锁反应又称为级联反应。能激活酚氧化酶原系统的物质统称为酚氧化酶原激活剂,常见的激活剂有ß-1,3-葡聚糖、脂多糖、肽聚糖、胰蛋白和十二烷基硫酸钠,加热或Ca2+浓度下降也可激活酚氧化酶原系统。
酚氧化酶原系统的内源性调控机制(图3)类似于高等动物中的补体激活旁路途径,其调控模式如下:当微生物或寄生虫等侵入机体后,小颗粒细胞和颗粒细胞表面模式识别蛋白与微生物表面的脂多糖、肽聚糖、甘露糖或ß-1,3-葡聚糖等保守分子结合,促使细胞扩张和部分脱颗粒,释放少量proPO和无活性的酚氧化酶原激活酶原前体(proppA)于细胞膜上,并激活ppA。活化后的ppA通过蛋白水解作用将proPO裂解为具有活性的酚氧化酶(PO)分子。酚氧化酶氧化单酚或双酚形成醌,然后再通过多聚化的非酶促反应产生黑色素。激活的proPO系统组分还可以将非活性的76kD蛋白转变为有活性的76kD蛋白,后者一方面可以促进血淋巴细胞对病原微生物进行包囊,另一方面又可以正反馈调节小颗粒细胞和颗粒细胞胞吐proppA。由于proPO系统主要存在于颗粒细胞中,因此,ß-1,3-葡聚糖结合蛋白和76kD蛋白就成为控制proPO系统释放的重要物质。通过proPO系统激活过程产生的黑色素及其代谢中间活性物质,可以多种方式参与免疫防御反应,包括提供调理素、促进血细胞吞噬作用、包囊作用和结节形成,以及介导凝集、产生杀菌物质等。此外,对甲壳动物酚氧化酶原系统的最新研究进展表明该系统成分还可直接参与免疫细胞间的信息传递。因此,酚氧化酶活性可作为衡量甲壳动物免疫功能的指标。
酚氧化酶原系统的外源性调控机制是脂类、胰蛋白、十二烷基磺酸钠、甲醇、乙醇和异丙醇等化学因子与酚氧化酶原结合后,使蛋白去折叠,导致酚氧化酶原构象发生变化,暴露其活性位点,从而活化酚氧化酶原。
(3)凝集素(Lectins)
凝集素是一类具有糖结合专一性、可促使细胞凝集的蛋白质或糖蛋白。凝集素广泛存在于生物体中,在植物、动物及微生物中均有发现。自1999年Hall等首先从鳌虾中克隆、分离和鉴定出凝集素蛋白以来,目前已在龙虾、寄居蟹、马蹄蟹、蓝蟹、美洲巨螯虾、中国明对虾、斑节对虾和日本囊对虾等40多种甲壳动物体内发现凝集素。甲壳动物的凝集素存在于血淋巴中或规则排列在血细胞膜表面,其实质是一个蛋白质家族,相对分子量为68-72kDa,具有结构异质性和异物结合位点的特异性,对热不稳定,56℃ 15min即可灭活,pH适应范围较广,最适pH为5-8。甲壳动物凝集素活性需Ca2+激活,但不能被葡萄糖、蔗糖、D-棉子糖、D-鼠李糖、D-果糖、L-阿拉伯糖、D-半乳糖、L-山梨糖、纤维二糖和麦芽糖所抑制。
凝集作用是甲壳动物免疫防御的主要机能之一。凝集素作为一种非特异性免疫识别因子(模式识别蛋白)识别自身和异己成分,包括外来入侵的病原微生物,并通过凝集、包围、调理、促进吞噬等方式将其排出体外。此外,凝集素还参与机体的止血、凝血、物质运输和伤口修复作用。在虾类变态期间,凝集素参与清除体内组织和细胞碎片的过程。研究表明凝集素活力的强弱与甲壳动物免疫水平密切相关,可作为衡量甲壳动物免疫功能的一项指标。
(4)溶血素(Hemolysin)
溶血素也是一种非特异性的免疫因子,目前已在多种无脊椎动物的血清中被发现,但有关甲壳动物溶血素的报道较少,仅限于美洲马蹄蟹、龙虾和日本对虾。研究表明甲壳动物的溶血素具有以下特性:①Ca2+离子和Fe2+离子是溶血素发挥生物学功能所必需的;②偏酸性或偏碱性环境对溶血素活性均有破坏作用;③溶血范围较广;④具有可诱导性,外源刺激物的诱导可以促使血淋巴中的溶血素浓度有所提高。⑤对热不稳定性,加热至56℃即可失活。
甲壳动物溶血素在免疫应答中的作用类似于脊椎动物的补体系统,具有溶解细胞和细菌作用以及免疫调理作用,并且还可能与酚氧化酶原系统的激活有关。
(5)抗菌肽(Antimicrobial peptides)
①抗菌肽的发现
抗菌肽是由动物和植物细胞特定基因编码的肽类抗微生物分子,广泛分布于整个生物界,是脊椎动物、无脊椎动物和植物防御细菌、真菌等病原微生物入侵的重要分子屏障。自1980年Steiner等在美国天蚕(Hyatophora cecropia)蛹中发现抗菌肽天蚕素以来,人们不断地从细菌、真菌、两栖类、昆虫、高等植物、哺乳动物和人类体内分离到抗菌肽。目前已从各种真核生物中分离到700多种抗菌肽,并确定了部分抗菌肽氨基酸结构和基因序列。随着研究工作的深入,人们发现抗菌肽除具有广谱高效杀菌活性外,对部分真菌、原虫、病毒及癌细胞等也具有强有力的杀伤作用。因此,许多学者认为将这类活性多肽称为抗微生物肽(antimicrobial peptides,AMP)更为合适。
②抗菌肽的分类
目前根据抗菌肽分子结构不同,将其分为以下四类:
线性两亲α螺旋型抗菌肽 目前己经发现此类抗菌肽有20多种,广泛分布于无脊椎动物、脊椎动物和人体内。此类抗菌肽的结构特征是分子内富含赖氨酸和精氨酸,不含半胱氨酸,不形成分子内二硫键,但能形成2个线性两亲的α-螺旋结构。
环型抗菌肽 此类抗菌肽又称为防御素(defensins),因其富含半胱氨酸,可形成分子内二硫桥而呈发夹式β片层结构或α螺旋与β片层结构的混合结构。
分子内富含脯氨酸的线性抗菌肽 此类抗菌肽带正电荷,又可分为两小类:一类是小分子活性肽,由15-34个氨基酸残基组成,其中脯氨酸含量在25%以上,分子结构中均含有精氨酸-脯氨酸或赖氨酸-脯氨酸对;另一类是分子量较大的活性肽,由83个氨基酸残基组成,分子结构中含有两个明显的结构域,即N端富含脯氨酸的P结构域和由其余富含甘氨酸的G结构域,这二个结构域可能与该类抗菌肽的广谱抗菌作用有关。
分子内富含甘氨酸的线性抗菌肽 这是近几年来才发现的一类抗菌肽,分子内富含甘氨酸,不能形成二硫键,氨基酸残基中不具有修饰基团。通常这类抗菌肽的N端有一个富含脯氨酸的P结构域,C端有一个富含甘氨酸的G结构域。
③抗菌肽的作用机制抗菌肽是重要的先天性免疫因子,广泛存在于生物界的各个门类,进化上相对保守,具有广谱的抗菌、抗病毒和抗肿瘤作用。目前研究比较清楚的是昆虫抗菌肽的抗细菌机制,包括细胞膜电势依赖通道的形成、抑制细胞呼吸、抑制细菌外膜蛋白的合成、抑制细菌细胞壁的合成、抑制热休克蛋白的ATP酶活性以及对病原微生物和肿瘤细胞染色体DNA的断裂作用。而对抗菌肽抗真菌的作用机理尚不清楚
胞膜电势依赖通道的形成抗菌肽扮演着离子泵的角色,它使细菌细胞内的K+快速被析出,ATP含量迅速下降,继而导致细菌细胞死亡。通过经抗菌肽处理后的脂质体膜的电势和电流的变化,也可以判断出抗菌肽在膜上形成了孔道,并且孔道的形成、开启和关闭都依赖于膜电势。只有当膜电势高于110mv时,孔道才能形成或处于开启状态。因此,这种孔道被称为电势依赖通道。最近,一些学者通过电镜直接观察到抗菌肽在细胞膜上形成的孔道,也为电势依赖通道的形成提供了直接证据。
抑制细胞的呼吸作用抗菌肽的抗菌机制也与抑制细菌和真菌细胞的呼吸作用有关。线粒体是细胞呼吸代谢最重要的细胞器,对经抗菌肽处理过的线粒体进行超微结构观察,发现线粒体出现肿胀、空泡化、嵴脱落和排列不规则,核膜界限不清,有的核破裂,内容物溢出。用40μ mol/L的抗菌肽处理细菌lh后,可检测到细菌的呼吸变弱;处理6h后,细菌的呼吸作用完全停止。
抑制细菌外膜蛋白的形成抗菌肽能够干扰大肠杆菌细胞外膜蛋白OmpC、OmpF、OmpA和LamB基因的转录,使相应的外膜蛋白表达量减少,从而导致细菌细胞膜的通透性增加,细菌生长受抑制。
抑制细菌细胞壁的形成 抗菌肽能够抑制细菌细胞壁的合成,使细菌不能维持正常形态而抑制细菌生长,甚至使细菌细胞壁破裂,导致细胞死亡。
抑制热休克蛋白的ATP酶活性 富含脯氨酸的抗菌肽能够与细菌热休克蛋白相结合,抑制其ATP酶活性,进而阻止它协助蛋白质的折叠,导致细菌正常生理功能受到抑制,甚至导致细菌死亡。
对病原微生物和肿瘤细胞染色体DNA的断裂作用 研究表明昆虫抗菌肽首先作用于病原微生物的外膜,然后破坏细胞器,最后破坏核膜,由此可以推测抗菌肽有可能对核内染色体起作用。单细胞凝胶电泳技术是一种快速灵敏的检测哺乳动物细胞单个DNA断裂的技术,一些学者采用此技术研究了昆虫抗菌肽对人髓样白血病细胞和正常人白细胞核染色质的影响,在荧光显微镜下观察到经抗菌肽处理后的癌细胞染色质DNA明显断裂,而正常人白细胞和未经抗菌肽处理的癌细胞未观察到DNA的断裂现象。这说明抗菌肽对某些癌细胞的DNA有断裂作用。同时也说明抗菌肽对癌细胞和正常人细胞具有选择性,但其选择机制尚不清楚。
在目前已知的抗菌肽多种抗菌机制中,抑制细胞的呼吸作用被认为是抗菌肽最重要的作用机制。当然同一种抗菌肽也可能通过多种途径发挥作用,了解不同抗菌肽的作用机制有助于抗菌肽的临床应用,使抗菌肽的研究开发更具有针对性。
蛋白质功能与结构的密切关系为抗菌肽的分子设计提供了理论依据,抗菌肽分子的改造与设计己经成为获得新抗菌肽的重要途径。目前,抗菌肽分子设计的主要策略是改变抗菌肽两性分子α-螺旋结构的氨基酸组成,增强其螺旋度,即可能获得活性更高、抗菌谱更广的抗菌肽。Boman设计了4种天蚕素(Cecropin)类抗菌肽的类似物,获得了与天然抗菌肽相似的合成肽。Jaynes等置换了Cecropin B中的许多氨基酸,结果使新抗菌肽分子的抗菌活性大大增强,作用范围更加扩大,甚至可以杀死原虫。Bomman将提取的Cecropin A与具有抗菌活性的蜂毒素melittin分子进行重组,形成的杂合肽不仅有更高的抗菌活性,而且还克服了蜂毒导致溶血的缺点。
(摘于文章片段)
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

