论文:柠檬酸调节水体酸碱度抑制黄丝藻藻华的研究
柠檬酸调节水体酸碱度抑制黄丝藻藻华的研究
王爱卿,杨仕豪,李西雨,潘连德
(上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室,上海201306)
摘要:用柠檬酸调节试验水体pH值,并保持在5.0、5.5、6.0和6.5四个梯度下,将采自养殖池塘的黄丝藻(Tribonema sp.)藻华的10 g藻丝体放入试验水体,每隔48 h采样一次,观察黄丝藻藻丝体外部形态、显微结构的变化。同时测定其叶绿素a(Chl a)、丙二醛(MDA)的含量和超氧化物歧化酶(SOD)、过氧化氢酶(CAT)的活性。结果表明:96 h黄丝藻藻丝体大量下沉,有些藻丝体断裂,无气泡产生,水体开始混浊;192 h水体混浊、藻丝体断裂并溶解的现象进一步明显;192 h各试验组藻细胞内叶绿体集于中央,并呈现不同程度的解体,细胞结构也变得模糊,细胞质膜与细胞壁之间的空隙增大。四个试验组Chl a含量明显低于对照组。对于SOD、CAT的活性,pH5.0的试验组呈现下降趋势,而pH 5.5、6.0、6.5的试验组呈现先增长后下降的趋势;各个试验组MDA明显高于对照组,这说明192 h后黄丝藻藻丝体受到严重的破坏,开始解体、死亡。试验得出结论:用柠檬酸降低水体pH值,可以有效抑制或杀死了黄丝藻,从而控制了黄丝藻藻华。
关键词:柠檬酸;黄丝藻(Tribonema sp);叶绿素a;抗氧化酶
在养殖水体,丝状藻类旺盛生长形成藻华(俗称青苔),消耗水体中无机盐,释放有毒物质,使水质变得清瘦,毒害水生生物[1]。虾、蟹颊部、额部、基关节附着丝状藻类,会使虾、蟹活动困难,进食减少,严重时致其窒息死亡[2]。在景观水体,藻类大量爆发时既影响水体的景观效果,也使水体散发异味,对周围环境造成影响[3]。
目前,常用控制藻类的方法主要有物理法[4]、化学法[5-7]和生物法[8-10]。尽管上述方法在短期内都能有效控制水体藻类,但长期使用会对生态系统产生压迫,并且经济成本高[11-12]。因此,需要寻找一种既能有效控制藻类,又对环境的破坏性小,便于长期操作的办法。
表层水体的pH是一个重要的环境因素,它能在很大程度上影响藻类种群的增长[13]。在排除其它外界环境因素的条件下,藻类只有在一定的pH值范围内才能生长良好,如果超出这个范围,藻类活性就会受到抑制或死亡[14]。藻类喜欢生长于偏碱性水体(pH7.7~9.4),因此在一定的范围内,可以把养殖水体pH值调到偏酸性,进而可以抑制藻类生长[15]。Axelsson等[16]发现在酸性条件下,高浓度的金属和低浓度的营养盐对藻类的生长有间接抑制效果,而氢离子的浓度对藻类有直接的破坏作用。
目前,针对丝状藻类的研究主要是其作为初级生产者对周围环境的影响[17-20],而作为有害藻华的相关研究较少[5,21]。本研究利用柠檬酸改变水体pH值来进行黄丝藻(Tribonemasp)藻华的抑制试验,探索养殖水体黄丝藻等丝状藻藻华的预防与控制的新思路和新方法。
1试验材料
柠檬酸购自国药集团化学试剂有限公司。超氧化物歧化酶(SOD)试剂盒、过氧化氢酶(CAT)试剂盒、丙二醛(MDA)试剂盒均购自南京建成生物工程研究所。
黄丝藻藻华采集于上海浦东新区临港新城一个养殖池塘,去除其上所附的杂草、螺类,放入超白玻璃缸内,注入河水,室内自然光照下暂养、备用。
2试验方法
2.1柠檬酸添加频率的确定
分别配置pH值5.0、5.5、6.0、6.5四个不同梯度的柠檬酸溶液,并设对照,每组设3个重复。连续进行pH值测定,以便于观察水体pH值的变化趋势,确定柠檬酸添加频率。
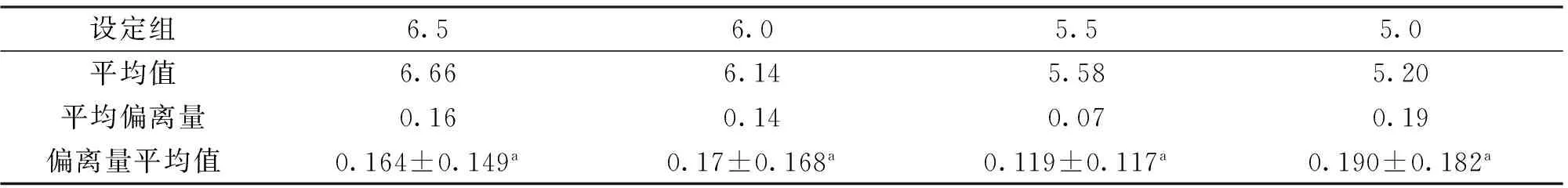
表1 不同处理组12 h 后的pH值变化
注:偏离量平均值中数据为平均值±标准差,后缀相同字母之间表示没有显著差异(P>0.05),不同字母者表示差异显著(P<0.05),下同。
由表1可知,12 h各试验组pH值与设定值出现一定的偏差,就平均值而言,pH值5.5时,偏离程度最小,pH值为5.0时,偏离程度最大。对每一次的偏离量的绝对值进行平均后发现,4个处理之间pH值偏离值没有明显差异。所以,确定间隔12 h为柠檬酸的最佳添加时间。
2.2黄丝藻藻丝体培养方法和条件
分别称取10 g的黄丝藻藻丝体,蒸馏水洗净,放于3 L含有BG11培养基的对照组(pH=7.8)与加有柠檬酸调节pH值为5.0、5.5、6.0、6.5四个不同梯度的BG11培养基中,日光灯照射,光照度为 2 000 lx,光暗比为 12 h∶12 h,温度22 ℃,充气培养。
2.3pH对黄丝藻藻丝体结构的改变
肉眼观察不同pH值条件下黄丝藻藻丝体颜色、沉降、光合作用产生的气泡,水体混浊现象及藻丝体的断裂与自溶等表观特征。
使用显微镜(型号:BH-2,×20倍、×40倍)分别观察不同pH值条件下黄丝藻细胞壁、细胞膜、色素体的变化。
2.4pH对黄丝藻藻丝体Chla含量的影响
每隔48 h取一次样,测定Chla含量,连续进行192 h。取0.12 g黄丝藻藻丝体,用吸水纸吸干,放入具塞刻度试管,迅速转移至冰箱冷冻室冷冻12 h和以上或过夜,取出后立即加入15 mL已经预热(80 ℃)的95%乙醇中,并在恒温水浴锅中80 ℃萃取2 min,紧接着使用超声波细胞粉碎仪(冰浴中)进行粉碎,放入4 ℃冰箱黑暗静置4 h后,转入有刻度的离心管中,定容至15 mL,离心10 min(4000 r/min),取上清液于分光光度计上测定663 nm、645 nm和630 nm下的吸光度值[22]。Chl a含量按照下列公式计算:
Ca=[11.64(OD663)-2.16(OD645)+0.10(OD630)]×V/M
式中:Ca为1 g藻丝体中所含的Chl a量(mg/g);V为定容的体积(L);M为称取的藻丝体的重量(g)。
2.5pH对黄丝藻藻丝体两种抗氧化酶活性及MDA含量的影响
每隔48 h取一次样,测定黄丝藻藻丝体两种抗氧化酶活性及MDA含量,连续进行192 h。参考Furey等[23]方法,取0.20 g的黄丝藻藻丝体,吸干、剪碎,加入冷却至4 ℃的0.05 mol/L磷酸缓冲液5 mL(pH=7.82,内含4 mmol/L EDTA-Na2),在冰水浴中用超声波细胞粉碎仪破碎,匀浆液8000 r/min、4 ℃下离心10 min,收集上清液,用于测定SOD、CAT、MDA,样品处理完后24 h内测定完毕。
2.6数据分析
试验数据用SPSS13.0单因素方差分析(One-way ANOVY)进行Duncan′s法多重比较,P>0.05表示差异不显著,P<0.05表示差异显著。
3结果
3.1pH对黄丝藻藻丝体结构的改变
3.1.1pH对黄丝藻藻丝体外部形态的改变
从图1、图2可以看出,试验组藻类由于受到不同程度的损害,96 h和192 h试验组与对照组出现了明显的差异性。192 h与96 h相比,pH 6.5的试验组,水体混浊度明显增加,无气泡产生,藻类颜色变为黄褐色,藻丝体断裂,沉于瓶底。pH 6.0的试验组混浊度增加,数量明显减少。pH 5.5和5.0的水体,几乎看不到藻丝体,说明基本已经溶解。

图1 96 h不同pH值条件下黄丝藻藻丝体外部形态结果

图2 192 h不同pH值条件下黄丝藻藻丝体外部形态结果
3.1.2pH对黄丝藻藻丝体显微结构的改变
从图3、图4中可以看出,192 h四个试验组与对照组出现了明显差异,pH5.0的试验组中毒现象最为严重,黄丝藻藻丝体接近死亡,与对照组相比,试验组的色素体集中于细胞中央,含量明显减少,颜色呈黄灰色,细胞结构也变得模糊,细胞质膜与细胞壁之间的空隙增大。随着pH值升高,则中毒现象减轻。pH值5.5、6.0、6.5的试验组藻类色素体含量高于pH值5.0的试验组,黄绿色藻类较多,这说明处理192 h各个试验组叶绿体受到破坏,叶绿素的合成受到阻碍。
3.2pH对黄丝藻藻丝体Chla含量影响
由表2,图5可知,在加入柠檬酸48 h,对照组pH值8.2,黄丝藻藻丝体Chla含量为0.972 mg/g,而pH值5.0、5.5、6.0、6.5实验组含量分别为0.558、0.605、0.707、0.822 mg/g,试验组与对照组表现明显的差异性。pH值5.5、6.0、6.5的试验组含量呈现先增长后下降的趋势,而pH值5.0的试验组一直保持下降趋势。说明pH值5.0的较酸性环境,使黄丝藻细胞受到破坏,所以没有进行增殖便开始死亡。而其它试验组由于受到酸性环境的有效刺激,促进其增长,但是随着时间的延长,则出现了抑制现象。
3.3pH对黄丝藻藻丝体两种抗氧化酶活性、MDA含量的影响
3.3.1pH对黄丝藻藻丝体SOD活性的影响
由表3,图6可以看出,pH值5.5、6.0、6.5的环境条件下,SOD呈现先增长后下降的增长趋势,而pH值5.0的试验组表现为下降趋势,但总体上都低于对照组。

图3 192 h后黄丝藻藻丝体显微结构中毒结果(×20)

pHChla含量/(mg/g)48h96h144h192h对照0.972±0.092a1.226±0.075a1.465±0.136a1.537±0.112a5.00.558±0.011d0.445±0.049c0.410±0.012d0.237±0.052e5.50.605±0.058cd0.833±0.082b0.644±0.018c0.464±0.021d6.00.707±0.08bc0.975±0.058b0.926±0.041b0.614±0.082c6.50.822±0.046b1.156±0.123a1.319±0.133a0.878±0.109b

图4 192 h后黄丝藻显微结构中毒结果(×40)

pHSOD活性/(U/mgprot)48h96h144h192h对照55.369±0.798c69.154±0.700a71.195±1.429a70.747±1.811a5.036.365±0.765e32.576±2.111c26.893±1.634c10.809±1.864e5.546.254±1.484d51.453±2.184b48.972±1.549b29.037±1.351d6.062.934±1.189b66.685±1.097a71.413±1.820a37.857±2.192c6.568.393±2.600a68.713±1.435a70.304±1.130a65.369±2.989b

图5 不同pH值对黄丝藻藻丝体叶绿素a含量的影响

图6 不同pH值对黄丝藻藻丝体SOD活性的影响
3.3.2柠檬酸对黄丝藻藻丝体CAT活性的影响
由表4,图7可知,试验组与对照组出现明显差异性,pH值5.5、6.0、6.5的试验组呈现先增长后下降的趋势,而pH值5.0的试验组保持下降趋势,并且都明显低于对照组。

表4 不同pH值对黄丝藻藻丝体CAT活性的Duncan′s比较
3.3.3pH对黄丝藻藻丝体MDA含量的影响
由表5,图8可知,试验组MDA含量明显高于对照组,192 h各个试验组呈先增长后下降的趋势,并且酸性越强,MDA含量越高。说明试验组黄丝藻藻丝体由于受到酸性环境的胁迫,细胞遭到破坏程度最严重。

表5 不同pH值对黄丝藻藻丝体MDA含量的Duncan′s比较
注:表中MDA单位:nmol/mgprot
4讨论
根据黄丝藻藻丝体结构的变化,叶绿素a含量和各种抗氧化酶指标的测定结果发现,192 h各个试验组与对照组相比,表现出明显的抑制效果。并且抑制率与酸度成正比关系。抑制率从高到低的顺序依次为:pH 5.0>pH 5.5>pH 6.0>pH 6.5>对照组。针对调节pH值来控制丝状藻的相关研究仍较少,但是Wang等[15]的研究表明:使用CO2调节试验水体pH值在5.5和6.0时,可以直接杀死铜绿微囊藻,而在pH值6.5的水体,铜绿微囊藻的生长受到抑制,但不会出现死亡。李静会等[24]

图7 不同pH值对黄丝藻藻丝体CAT活性的影响

图8 不同pH值对黄丝藻藻丝体MDA含量的影响
使用醋酸治理玄武湖蓝藻藻华实验结果表明:当平均用量为26.87 g/m3,水体表面pH值为5.5时,实验区藻类总量下降了82.8%。这与本试验研究有相似之处,说明一定的酸性条件可以抑制或杀死藻类。但对于不同的藻类,其抑制效果可能会有差异。对于其作用机理有两种推测,其一:过量的H+降低碳酸酐酶活性,从而使CO2浓缩机制受到影响,进而导致藻类死亡[25];其二:过量的H+对藻细胞的内部结构有直接的破坏作用,从而使光合作用受到影响;特别是降低细胞质和叶绿体内pH值,从而阻止卡尔文循环,因此降低了开放式光合系统II反应位点数量[26]。
Chla在光合作用的光能收集、传递和转化中起不可替代的作用,其含量的高低直接影响植物对于光合能量的利用,进而影响到光合能量的净积累,最终会以产量和生物量的形式表现出来[27]。本研究中四个试验组的Chla含量明显低于对照组,这可能是由于酸性条件抑制了黄丝藻藻华Chla的合成或造成了Chla的分解。有研究表明:pH值5.5、6.0、6.5的环境条件下,铜绿微囊藻和鱼腥藻的Chla含量明显下降[16]。这与本试验的结果相似。
藻类光合作用过程包括光化学过程和酶促过程。藻类光合磷酸化过程的速度受酶控制,而酶在水溶液环境中的解离状态和行为,都受到氢离子浓度的影响。氢离子浓度对酶促反应的速度不仅有明显的影响,而且影响机理也不同[28]。对于酸性条件下,藻类各种抗氧化酶活性的变化目前还没有研究。本试验的研究结果显示除pH值5.0的试验组藻丝体SOD、CAT活性随时间呈下降趋势外,其它试验组均表现为先增长后下降的趋势,表明了当过度的酸性环境刺激,会造成抗氧化酶系统的失活,而适度的酸性环境胁迫会增强抗氧化酶活性,从而加强了清除活性氧的综合能力。但是随着处理时间的延长和胁迫程度的加重,各种抗氧化酶协同清除活性氧的综合能力下降,就会积累更多的活性氧,产生严重的氧化胁迫,进而影响细胞活性。
结合试验结果和分析表明,在使用柠檬酸调节水体pH值在5.0~6.5之间,对黄丝藻藻丝体都有一定的抑制效果。因此,在黄丝藻等丝状藻藻华爆发的养殖水体,可以通过人为方法适当改变水体pH值以达到抑制丝状藻藻华的目的。
参考文献:
[1]彭刚,严维辉,刘国兴,等.3种药物对青苔生长的抑制效果研究[J].安徽农业科学,2013,41(12):5367-5369.
[2]仓基俊,左倬,郭萧,等.青苔在微污染水体生态净化系统中的发生与防治[J].安徽农业科学,2012,40(9):5524-5526.
[3]彭俊杰,李传红,黄细花.城市湖泊富营养化成因和特征[J].生态科学,2004,23(4):370-373.
[4]梁好,韦朝海.高铁酸盐预氧化,絮凝除藻的实验研究[J].工业水处理,2003,23(3):26-29.
[5]陈孝花.除藻剂对黄丝藻藻华叶绿素a含量和抗氧化酶活性的影响[D].上海:上海海洋大学,2011.
[6]肖锋,尹平河,赵玲,等.两种碘制剂对球形棕囊藻的去除作用[J].暨南大学学报:自然科学与医学版,2008,27(1):129-133.
[7]李锋民,胡洪营.植物化感作用控制天然水体中有害藻类的机理与应用[J].给水排水,2004,30(2):1-4.
[8]况琪军,吴振斌,夏宜.人工湿地生态系统的除藻研究[J].水生生物学报,2000,24(6):655-658.
[9]李雪梅,简曙光.有效微生物群控制富营养化湖泊蓝藻的效应[J].中山大学学报:自然科学版,2000,39(1):81-85.
[10]Barry M J,Logan D C.The use of temporary pond microcosms for aquatic toxicity testing:direct and indirect effects of endosulfan on community structure[J].Aquat Toxicol,1998,41(1):101-124.
[11]de Oliveira-Filho E C,Lopes R M,Paumgartten F J R.Comparative study on the susceptibility of freshwater species to copper-based pesticides[J].Chemosphere,2004,56(4):369-374.
[12]Chorus I,Bartram J.Toxic cyanobacteria in water:a guide to their public health consequences,monitoring and management.[M].London:Spon Press,1999.
[13]Agrawal S C,Singh V.Vegetative survival,akinete formation and germination in three blue-green algae and one green alga in relation to light intensity,temperature,heat shock and uv exposure[J].Fol Microbiol,2000,45(5):439-446.
[14]Twist H,Edwards A C,Codd G A.Algal growth responses to waters of contrasting tributaries of the river dee,north-east scotland[J].Wat Res,1998,32(8):2471-2479.
[15]Wang X,Hao C,Zhang F,et al.Inhibition of the growth of two blue-green algae species ( microsystis aruginosa and anabaena spiroides) by acidification treatments using carbon dioxide[J].Biores Technol,2011,102(10):5742-5748.
[16]Axelsson L,Mercado J,Figueroa F.Utilization of HCO3-at high pH by the brown macroalga laminaria saccharina[J].Eu J Phycol,2000,35(1):53-59.
[17]周杰,王晓琼,裴国凤.丝状绿藻种植水对栅藻和微囊藻生长的影响[J].中南民族大学学报:自然科学版,2008,27(3):32-35.
[18]Mohr S,Berghahn R,Feibicke M,et al.Effects of the herbicide metazachlor on macrophytes and ecosystem function in freshwater pond and stream mesocosms[J].Aquat toxicol,2007,82(2):73-84.
[19]Johnson M,Shivkumar S,Berlowitz-Tarrant L.Structure andproperties of filamentous green algae[J].Mater Sci Engin:B,1996,38(1):103-108.
[20]Ozimek T.Aspects of the ecology of a filamentous alga in a eutrophicated lake[J].Hydrobiologia,1990,191(1):23-27.
[21]陈孝花,潘连德,张饮江.水中丝状藻类有害藻华的形成与对策[J].南方水产科学,2011,7(2):77-82.
[22]杨彩根,宋学宏,孙丙耀.浮游植物叶绿素a含量简易测定方法的比较[J].海洋科学,2007,31(1):6-9.
[23]Furey A,James K,Allis O,et al.Bioaccumulation and harmful effects of microcystin-lr in the aquatic plants lemna minor and wolffia arrhiza and the filamentous alga chladophora fracta[J].Ecotoxicol Environ Saf,2005,61(3):345-352.
[24]李静会,高伟,张衡,等.除藻剂应急治理玄武湖蓝藻水华实验研究[J].环境污染与防治,2007,29(1):60-62.
[25]Cheng L H,Zhang L,Chen H L,et al.Advances on CO2fixation by microalgae[J].Chin biotechnol,2005,21(2):177-181.
[26]Satoh A,Kurano N,Miyachi S.Inhibition of photosynthesis by intracellular carbonic anhydrase in microalgae under excess concentrations of CO2[J].Photosynth Res,2001,68(3):215-224.
[27]马剑敏,马顷,苏秀燕,等.水绵对3种沉水植物的化感作用研究[J].河南农业科学,2011,40(9):70-73.
[28]王宪,李文权.盐度,pH对海洋藻类光合作用速率的影响[J].海洋环境科学,1991,10(1):37-40.
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

