论文:淡水精养池中浮游植物对微生物调水剂的生态响应
淡水精养池中浮游植物对微生物调水剂的生态响应
向劲,程小飞,谢敏,李金龙,宋锐,彭治桃
(湖南省水产科学研究所,湖南 长沙 410153)
四大家鱼(草鱼、鲢、鳙、青鱼)是我国淡水池塘养殖的主要种类,其产量一直保持在淡水鱼总量的50%以上,发挥着重要的经济与社会价值[1]。但是,其生产方式大多呈现出重产出而轻养水的特点[2,3]。近十多年,从清淤、生物浮床、鱼种搭配、改善设施、泼洒调水剂等多个角度开展试验,以解决池塘养殖中增效、节能、减排的兼顾问题[4-6]。其中,以微生物制剂调节池塘水质的研究起步较晚。大量研究表明,良好的微生态环境对池塘养殖具有重要意义[7-14]。其研究方法多以进行养殖效果对比为主,辅以监测水体氮磷、溶氧、叶绿素Chl-a 水平等理化指标,但利用池塘浮游生物群落变化评价微生物制剂调水功能的研究鲜有报道。
水生态系统中浮游植物群落与微生物具有直接和间接的相互影响关系[15-17]。为了进一步认识微生物群落对浮游植物群落的生态影响及总氮总磷在其中的作用,本文在精养塘中以不同用法施用微生物制剂,监测各时期的浮游植物群落变化,比较分析家鱼精养池中浮游植物群落对微生物调水剂的生态响应及其原因,以期为池塘养殖的水质调控提供科学依据,为微生物制剂对浮游植物的影响研究提供数据支持。
1 材料与方法
1.1 样品采集
试验在湖南省水产科学研究所家鱼养殖基地的3 个面积为8×667 m2鱼池(泼菌组、加磷泼菌组、对照组)中进行。试验鱼池年初各放草鱼Ctenopharyngodon idellus 1 400 kg、滤食性鱼类700 kg,且水源、鱼池形状方位、水深和投饲管理等条件均一致。2018 年8 月24 日泼菌组池塘均匀泼洒红糖活化2 h 后的EM 菌及芽孢杆菌75 g/667 m2;加磷泼菌组池塘先后泼洒过磷酸钙(有效P2O5为500 g/667 m2)及红糖活化2 h 后的EM菌及芽孢杆菌75 g/667 m2;对照组池塘仅泼洒红糖溶剂(红糖质量等于前两组用于菌类活化的量)。试验期间,3 个池塘均不换水及补水。2018 年8 月23 日(泼菌前)和9月3 日(泼菌后)晴天多云上午,参照《内陆水域渔业自然资源调查手册》[18]分别采集这3 个池塘水样。
1.2 样品处理及数据分析
1.2.1 浮游植物定性
将25#浮游生物网挂上竹棍并绑定,在水体不同深度做“∞”形循回拖动,然后将网内浓缩的水样放入50 mL 的标本瓶中固定。带回实验室后用滴管汲取适量样品制成标本片,在光学显微镜下观察浮游植物的形态结构特征以进行属、种的鉴定。
1.2.2 浮游植物定量
用1 L 容量的Palatas 采水器对截面三个点(长边塘埂的两侧中间点及池塘中心)采集混合水样3 L,现场使用鲁哥氏液(1%)摇匀固定,带回实验室静置,收集浓缩液后定容到50 mL。将浓缩水样充分摇匀后,滴取0.1 mL 于生物计数框,在显微镜下观察计数并根据公式计算出浮游植物密度(cells·L-1)。浮游植物生物量是由浮游植物密度与对应的浮游植物细胞平均湿重值相乘得到,但是,主要种必须先用体积法进行实际测量,然后以每109μm3体积换算为1 mg 鲜藻重,即求得生物量(mg·L-1)[19]。
1.2.3 总氮、总磷的测定
采集水样时现场测量池塘水温并记录,8 月23日水温为31.8℃,9 月3 日水温为28.6℃。总氮(TN)和总磷(TP)的测定方法分别为碱性过硫酸钾消解紫外分光光度法(GB11894-89)和过硫酸钾消解钼酸铵分光光度法(GB11893-89)。
1.2.4 物种多样性分析
淡水浮游植物生物多样性分析的方法有多种,使用一种多样性指数常会造成分析结果不够完善[20],本文同时采用Simpson 多样性指数(D)和Shannon-Wiener 指数(H)两种方法分析3 组水体的物种多样性,其公式分别为:
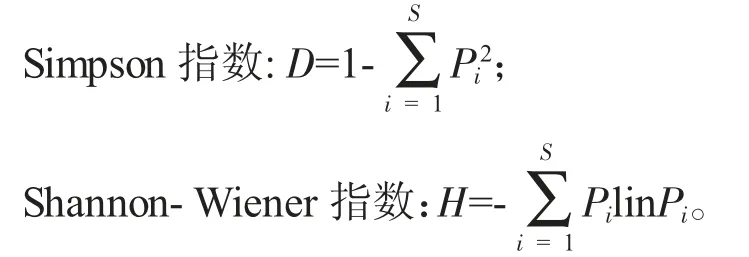
式中,S 为物种的数目(种数),Pi为种i 的个体在全部个体中的比例。
2 结果与分析
2.1 浮游植物群落的定性分析
试验期间,3 个鱼池共观察到浮游植物81 种(属),其中绿藻门最多,为35 种,占种类总数43%;其次为蓝藻门23 种,占28%;硅藻门10 种,占12%;其他门的种类数较少(图1)。

图1 浮游植物种类组成Fig.1 Species composition of phytoplankton
图2 为试验前后两次(8 月和9 月)各池的浮游生物种类数分布。由图2 可知,浮游植物种类数最多及最少均出现在9 月,加磷泼菌组(9 月)浮游植物种类数最多,为61 种;对照组(9 月)种类数最少,为52 种。泼菌组的浮游植物由8 月的57 种增长到9 月的58 种,略有增长;加磷泼菌组由8 月的56 种增长到9 月的61 种,增长比较明显,其中主要是绿藻门由26 种增长到31 种;而对照组的种类数由8月的56 种减少到9 月的52 种,绿藻、蓝藻和硅藻门种类数均有减少。

图2 各组水体试验前后的浮游植物门类分布Fig.2 The prevalence frequency of phytoplankton in phylum in water of each group before and after the experiment
2.2 浮游植物群落的定量结果
3 个试验组水体中浮游植物密度范围为5.97×107~15.89×107cells·L-1,最低值出现在8 月(试验前)的对照组,最高值出现在9 月(试验后)的加磷泼菌组。由图3 可知,试验期间3 组水体浮游植物密度变化趋势一致,变动幅度差距较小。

图3 不同试验组水体中浮游植物密度的变化趋势Fig.3 The variations in phytoplankton density in water in various groups
3 个试验组水体中浮游植物生物量范围为7.65~18.03 mg·L-1,最低值出现在8 月泼菌组,最高值出现在8 月对照组。前后生物量变化见图4,对照组的浮游植物生物量减少,而泼菌组和加磷泼菌组的水体浮游植物生物量在试验期间均有增长。

图4 不同试验组水体中浮游植物生物量变化趋势Fig.4 The variations in phytoplankton biomass in water in various groups
表1 为3 组水体试验前后浮游植物各门对整体生物量的贡献度变化,泼菌组的绿藻门和硅藻门大幅增长,裸藻门大幅减少;加磷泼菌组的蓝藻门和绿藻门增长明显,硅藻门有所减少;对照组各门变化不大,蓝藻门生物量始终保持在较高水平,仅硅藻、裸藻门明显减少。

表1 不同试验组水体中浮游植物各门生物量变化Tab.1 Biomass changes in each phylum of phytoplankton in water in various groups
现将水体中藻类平均体质量K 值[21](K=生物量/密度)作为单个浮游植物平均大小的参考值,即K 值越大,个体越大,K 值越小,个体平均越小。3 组水体中浮游植物相对大小的比较结果见图5。由图5 可知,试验期间泼菌组的K 值略有减少,加磷泼菌组基本不变,对照组大幅减小,反映出对照组水体的浮游植物个体明显趋于小型化,而泼菌组与加磷泼菌组的变化不明显。

图5 不同试验组水体中浮游植物的平均体质量K 值的变化趋势Fig.5 The variation in average weight K value of phytoplankton in water in various groups
2.3 主要种
试验期间3 组水体共7 种主要种(表2),其中蓝藻门5 种,绿藻门2 种。试验开始时(8 月),泼菌组的主要种为蓝藻门的不定微囊藻Microcystis incerta 和铜绿微囊藻Microcystis aeruginosa;试验结束时(9 月),主要种为蓝藻门的微小平裂藻Merismopedia tenuissima 和绿藻门的单角盘星藻Pediastrum simplex。加磷泼菌组在试验开始时主要种为蓝藻门的不定微囊藻、铜绿微囊藻、细浮鞘丝藻Planktolyngbya subtilis 和绿藻门的单角盘星藻;试验结束时,主要种为蓝藻门的不定微囊藻、细浮鞘丝藻以及绿藻门的单角盘星藻、纤细新月藻Closterium gracile Breb.。试验开始时对照组的主要种为蓝藻门的不定微囊藻、铜绿微囊藻(和节旋藻Arthrospira platensis;试验结束时,主要种为蓝藻门的不定微囊藻、铜绿微囊藻和微小平裂藻。

表2 试验前后不同试验组水体中浮游植物主要种的分布与变化Tab.2 Distribution and variation of main species phytoplankton in water in various groups before and after the experiment
主要种的生态指示作用具有一定积极意义,在使用上较为直观且简便[22],现将各水体中的藻类主要种作为水环境类型的指示生物[23-26]。蓝藻门5 种为富营养型或中-富营养型,绿藻门2 种为中营养和寡污型指示生物,后者对水环境的质量要求明显高于前者。现以蓝藻门和绿藻门分门计数,试验前后对照组无变化,均为蓝藻门;泼菌组和加磷泼菌组主要种在试验后均比试验前增加了绿藻门的1 种。
2.4 多样性指数
由表3 可知,试验期间,泼菌组的Simpson 多样性指数从0.839 略降至0.822,另两组的Simpson 指数则有所增大;3 组水体的Shannon-Wiener 指数均有所增大,未见差异。整体来说,3 组水体的浮游植物生态系统均较稳定。

表3 不同试验组水体中浮游植物多样性指数变化Tab.3 Variation in phytoplankton diversity index in water in various groups
2.5 水体中总氮总磷含量的变化及其比值
由图6 可知,试验期间3 组水体的总氮(TN)含量变化趋势是:对照组小幅增加,而泼菌组与加磷泼菌组的TN 含量急剧下降。增加外源性磷有促进对藻类增殖的作用,当输入磷含量达到1.65 mg·L-1时,促进作用消失[27]。本试验中3 组水体前后测量的总磷(TP)含量均低于1.65 mg·L-1,说明水体并未达到磷饱和状态。由图7 可知,泼菌组与对照组总磷TP 含量大幅减少,加磷泼菌组在试验期间对水体补充了过磷酸钙,导致TP 含量减少幅度相对较少。

图6 总氮(TN)变化趋势Fig.6 The changes in total nitrogen(TN)levels

图7 总磷(TP)变化趋势Fig.7 The change in total phosphorus(TP)levels
水中的氮磷比值可初略判断限制浮游植物生长的营养物质是氮元素还是磷元素[28]。当水体中的N/P 值大于20 时,被认为是P 限制,比值位于10~20 之间时,限制性因素并不明确,比值低于10时,被认为是N 限制[29,30]。试验中3 组水体的氮磷比值(N/P)前后变化分别为:泼菌组5.9~8.5,均小于10,为氮限制型水体;加磷泼菌组11.3~11.7,均在10~20 之间;对照组12.5~38.2,前值于10~20 之间,后值大于20,为磷限制型水体。
3 讨论
3.1 微生物制剂对总氮(TN)变化的影响
关于微生物制剂对水体总氮(TN)的影响,以往的研究结果较为一致。魏逸峰等[31]在凡纳滨对虾Litopenaeus vannamei 苗养殖中使用微生物制剂,结果显示,养殖环境中总氮含量低于未添加微生物制剂组。张悦[32]监测了西安沪灞生态区不同富营养化类型的水体氮含量,发现微生物与总氮含量呈显著相关关系。王新等[33]在南美白对虾养殖后期进行微生物制剂试验发现,2 周后水体总氮去除率达到34.1%以上,并通过监测养殖水体中的细菌群落变化,推测微生物制剂主要以调控养殖池中的原有微生物群落以达到其净水效果。本试验中,对照组水体中的总氮含量增加,而泼菌组与加磷泼菌组均有所下降,与上述结果完全一致,即微生物调水剂在短时期内能降低水体总氮含量。
3.2 微生物制剂对总磷(TP)含量的影响及补充磷元素的调水效果差异
在以往的研究中,多同步监测总磷监测与总氮,结果中微生物制剂能有效降低总氮含量和总磷含量。张文斌等[34]从沉积微生物角度试验提出有藻条件下,沉积微生物的活性越强,沉积物中氮磷的释放量越大,即水体中氮磷含量越高。鲜莹[35]在富营养稻渔养殖水体中使用微生物制剂,发现筛选、扩培出的有较强产胞外碱性磷酸酶和蛋白酶能力的菌株能降低水体氮磷含量。谢永斌[36]对鲤Cyprinus carpio 养殖池塘进行为期28 d 的监测,发现使用微生物制剂的池塘总氮总磷均低于未使用微生物制剂的池塘,且总磷差异显著(P<0.01)。但是,本试验中,3 组水体的总磷含量均降低,变化趋势无差异,或可由底泥扰动对水体中磷迁移和转化的作用大于藻这一结论进行解释[37]。而使用微生物制剂的池塘与未使用微生物制剂的池塘的总磷变化趋势无规则,或由3 组水体中的氮磷比差异引起。水体中氮磷变化受到微生物、浮游生物及其他生态、理化因子的共同影响,而氮磷比又能反过来影响这些生态进程。如对云南洱海过去20 余年的水质研究中,总磷对浮游生物的相对重要度在持续攀升,说明水体中浮游植物对氮磷的需求量是一个动态过程[38]。还有研究发现,水体中氮磷比不同会导致浮游植物群落分布及对氮和磷元素的利用效率也不一致[39-42],氮磷比能影响微生物的硝化作用进而影响氮磷元素分布[43]。为探究补充磷元素对调水效果的影响,本研究单独比对了泼菌组和加磷泼菌组前后的主要种分布,试验结束时,泼菌组的主要种为蓝藻门的微小平裂藻和绿藻门的单角盘星藻,加磷泼菌组的主要种为蓝藻门的不定微囊藻、细浮鞘丝藻以及绿藻门的单角盘星藻、纤细新月藻。纤细新月藻(寡污)仅成为加磷泼菌组试验结束时的主要种,表明在对精养水体(尤其是N/P 值高于10)使用微生物调水制品时,适量补磷,降低氮磷比有助于促进水体营养物质的利用与转化,间接优化水环境质量。
3.3 微生物制剂对浮游植物群落的影响
关于微生物制剂对浮游植物群落影响的报道较多,大多认为,微生物制剂能促进有益藻、抑制有害藻生长达到调节藻相的作用,进而优化水生态环境[44]。具体分析微生物制剂对浮游植物各门类分布的影响,郑侠飞[45]的单藻种培育试验表明,微生物制剂能显著促进绿藻门的小球藻Chlorella vulgaris生长;陈书秀和王伟伟[46]研究显示,微生物制剂对金藻、硅藻、绿藻的生长有促进作用。与上述研究结果一致,本试验中对照组的浮游植物种类数由56种减少到52 种,而使用微生物制剂的泼菌组和加磷泼菌组均有增长,均为绿藻门种类;对照组的浮游植物生物量和绿藻门生物量略降,而泼菌组及加磷泼菌组生物量均小幅增长,主要由绿藻门增长。微生物制剂在短期范围内提高了精养水体的浮游植物种类数和生物量,且主要是由提高绿藻门种类数及生物量造成。
3 组水体的藻类多样性(Simpson 和Shannon-Wiener)指数均较稳定,变化趋势无差异。对照组的藻类平均体质量K 值由3.02 急剧减少到1.24,而泼菌组与加磷泼菌组的K 值无明显变化,反映出微生物制剂可阻止精养池中浮游植物的个体小型化。这很可能是微生物制剂中的芽孢杆菌、EM菌等对水体中微小型浮游植物的生长和繁殖产生竞争或抑制作用[47,48],甚至是裂解浮游植物细胞[49]。
试验前后对照组池塘水环境的主要浮游植物种均属中-富营养型的蓝藻门,而泼菌组与加磷泼菌组在试验期间均增加1 种对水环境要求更高的绿藻门藻类。这与吴定心[13]的研究结果一致,表明微生物制剂在短期内优化了精养水体中的藻类群落生态结构。
综上所述,使用微生物制剂在短时期内对精养水体的浮游植物密度、生物多样性均无明显影响,对种类数分布、生物量组成、平均体质量K 值及主要种变化有较大影响且多为积极影响。在使用微生物制剂的同时泼洒适量磷肥调节氮磷比,改善池塘的磷限制型水体状态,可促进其调水效果。本文认为,在微生物制剂对浮游植物群落变化产生影响的基础上,可以同时监测池塘中的微生物群落变化及更多水体理化因子,进一步探究微生物群落与浮游生物群落在精养池中的生态联系,为微生物制剂的应用及池塘水质管理提供参考。
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

