鱼类鮰爱德华菌与鮰爱德华菌病研究进展
鱼类鮰爱德华菌与鮰爱德华菌病研究进展
黄 华,刘锡胤,张秀梅,王 鹤,王晓飞
(烟台市海洋经济研究院,山东烟台 264003)
自1979年美国HAWKE首次从患病斑点叉尾鮰(Ictaluruspunctatus)发现鮰爱德华菌(Edwardsiellaictaluri)后,在澳大利亚、泰国、越南等国先后出现鮰爱德华菌病报道。近年来,中国江苏、浙江、四川、广东、湖北、湖南、河南和重庆等省市也相继发现该病[1],受感染的鱼类发病率和死亡率都很高,对鱼类养殖构成严重威胁。为了更好地防治该病,将国内外对鮰爱德华菌与鮰爱德华菌病的研究进展进行了总结。
1 鮰爱德华菌研究进展
1.1 分类地位
鮰爱德华菌分类地位为变形菌门(Bacteria),γ-变形菌纲(γ-Proteobacteria),肠杆菌目(Enterobacteriales),肠杆菌科(Enterobacteriaceae),爱德华菌属(Edwardsiealla),曾被称为爱德华氏菌“GA7752”群,有研究也将其称为鮰爱德华氏菌或鮰鱼爱德华菌[2]。鮰爱德华菌为爱德华菌中生化活性最低的1个种,尚未出现明显的生物型变种[3]。鮰爱德华菌与迟缓爱德华菌(Edwardsieallatarda)在许多生化反应上相同,为区分鮰爱德华菌与迟缓爱德华菌,将其生化特性区别列于表1[3]。同时可从DNA层面进行区分,鮰爱德华菌DNA中鸟嘌呤G加胞嘧啶C克分子百分比(G+C mo1%)为53(Bd),其模式株为ATCC33202(CDC1976278,GA7752),而迟缓爱德华菌DNA中(G+C mo1%)为55~58(Bd),模式菌株为ATCC15947(DSM30052)[3]。
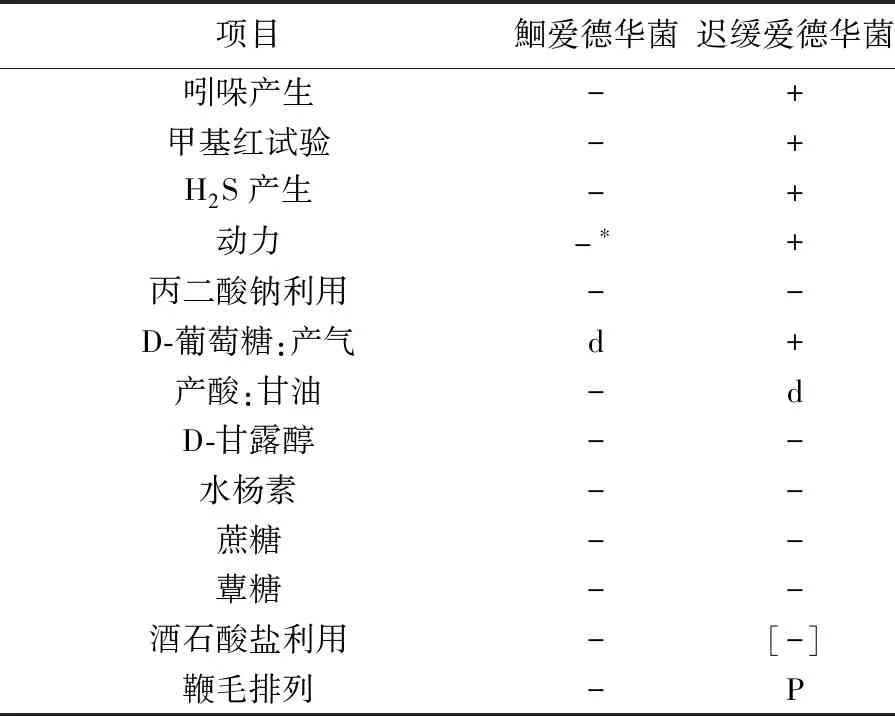
表1 鮰爱德华菌与迟缓爱德华菌生化特性区别Tab.1 Biochemical characteristics of Edwardsiella ictaluri and Edwardsiealla tarda
注:-为0~10%阳性,[-]为11%~25%阳性,d为26%~75%阳性,+为90%~100%阳性;P为周毛。此表中的“-”是在(36±1)℃培养的结果;*符号为作者加注,表示该菌在约28℃培养时是有动力的
Notes: -: 0~10% positive,[-]: 11%~25% positive,d: 26%~75% positive,+: 90%~100% positive,P: peripheral flagellum.“-”: The results of being cultured at(36±1)℃;*: The bacteria are dynamic when cultured at about 28℃
1.2 生物学特性
鮰爱德华菌菌体短杆状,大小为(0.8±0.2)μm×(2.5±0.5)μm,革兰氏染色阴性,兼性厌氧,靠周生鞭毛运动,无荚膜,不形成芽孢。鮰爱德华菌在该属细菌中属较难培养的1种,在脑心浸液琼脂(BHIA)培养基平板上生长较缓慢,常常需要培养48 h左右才能形成直径1~2 mm、圆形光滑、边缘整齐、稍隆起的无色小菌落。爱德华菌属其他菌种在37℃下生长良好,而鮰爱德华菌最适温度为25℃~30℃,在37℃时生长缓慢或完全不能生长,在28℃左右时能表现出微弱的运动力[3]。
1.3 致病因子
近年来,学者对鮰爱德华菌致病因子研究逐渐增多。细菌的Ⅵ型分泌系统(T6SS)与细菌毒力密切相关,参与细菌的群体感应信号调节[4],对鮰爱德华菌全基因组测序发现,该菌拥有完整的T6SS编码基因[5],在鮰爱德华菌致病过程有重要作用[6]。EivpP是Ⅵ型分泌系统的主要效应蛋白之一[7],其表达影响细菌内化及侵入宿主细胞的过程,从而影响细菌对宿主的致病作用[8]。鮰爱德华菌的EivpP可以阻碍宿主胞浆中Ca2+的增加,使Ca2+依赖性的c-Jun N-末端激酶(JNK)无法被激活,进而影响炎症小体接合器ASC寡聚化和效应亚基caspase-1的裂解,致使核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症小体激活失败,且宿主无法分泌白细胞介素1β(IL-1β)和白细胞介素18(IL-18)。最终,EivpP通过抑制炎症小体的激活促进鮰爱德华菌在宿主体内的增殖[9]。
外膜蛋白(outer membrane proteins,OMPs)是革兰氏阴性细菌外膜的主要结构成分,其表面暴露的抗原决定簇可与宿主结合引发免疫反应,具有良好的免疫保护作用,因此许多细菌的OMPs被列入疫苗的候选成分[11-14]。通过十二烷基肌氨酸钠(Sarkosyl)抽提并结合超速离心的方法可提取主要外膜蛋白(OMPs)。李强等[15]研究表明,黄颡鱼(Pelteobagrusfulvidraco)体内分离的鮰爱德华菌OMPs中36 000蛋白和30 000蛋白具有很好的免疫原性,36 000蛋白尤甚。研究发现,ompN基因在鮰爱德华菌基因组DNA全序列中出现了3次,分别是ompN1、ompN2、ompN3,参与了细菌在体内的磷酸化作用、信号转导、糖类的转运易位等诸多活动和功能[16],其中位于细胞膜外表面的ompN2基因编码的蛋白产物是鮰爱德华菌重要的毒力因子之一,参与细菌的致病过程[16],且抗原表位有9个与免疫相关的抗原决定簇区域[17]。
OmpLC(outer membrane porin protein LC)作为一种特定外膜蛋白,能够作为噬菌体ΦeiAU和ΦeiDWF的吸附受体[18]。黄艳青等[19]采用PCR方法从鮰爱德华菌基因组中扩增出外膜蛋白OmpLC基因,分析了鮰爱德华菌外膜蛋白OmpLC基因序列片段大小为1 133 bp,该基因的cDNA从32到1 111全长1 080 bp,编码360个氨基酸,该蛋白是一种稳定的强亲水性蛋白,有信号肽,成熟蛋白无跨膜螺区,序列与OmpLC蛋白(AEQ59632、AEQ59639)具有高度同源性,且在系统发育树上与二者聚为一簇。
1.4 入侵鱼体途径
鮰爱德华菌侵染鱼类的方式主要有3种:一是通过鼻孔(嗅球)侵入,并在嗅囊内增殖,然后沿嗅觉神经系统进入鱼类脑部,导致大脑内形成肉芽肿性炎症,表现为慢性的脑膜炎[20];二是通过胃肠壁进入鱼体,随血液循环到达鱼体各个器官组织,导致鱼类败血症,机体表现为急性出血症,例如斑点叉尾鮰肠道败血症(enteric septicemia of catfish,ESC)[21]。BOOTH等[22]研究发现,鮰爱德华菌穿过肠上皮后,被巨噬细胞吞噬,一旦存活下来,就会通过血液传播到其他组织器官,最终引起败血症导致鱼类死亡;三是通过鳃入侵鱼类。NUSBAUM等[23-24]研究发现,将斑点叉尾鮰浸泡在同位素标记的鮰爱德华菌中,最先在鳃上皮发现大量该菌,浸泡5 min后,在血液中分离出了鮰爱德华菌,后依次在肝、后肾、肠道和脑中检测到该菌,研究发现,该菌能较快突破鱼体屏障进入血液,并迅速扩散到全身。
2 鮰爱德华菌病流行情况与检测方法
2.1 流行情况
鮰爱德华菌病暴发具季节性,通常发生于水温25℃左右的春、秋季[25]。鮰爱德华菌宿主范围较窄,主要感染鮰科鱼类,例如斑点叉尾鮰[26]、北美的犀目鮰(Ameiuruscatus)[26]和黑鮰(Ameiurusmelas)[26]等,其中斑点叉尾鮰最易感染,可引发斑点叉尾鮰肠道败血症[27]。研究发现一些非鮰科鱼类也被感染,例如引发黄颡鱼“红头病”[28],还可感染泰国蟾胡鲶(Clariasbatrachus)[29]、欧鲇(Silurusglanis)、虹鳟(Oncorhynchusmykiss)[30]、大口黑鲈(Micropterussalmoides)、罗非鱼等鱼类。
2.2 检测方法
首先通过观察临床症状,对病变情况和流行季节特点做初步诊断,然后通过微生物学检测技术、免疫学与分子生物学等实验手段进一步检查,以判断鱼类是否感染鮰爱德华菌。
2.2.1 临床症状观察
鱼感染鮰爱德华菌后,早期表现为食欲减退、游动迟缓,离群独游、严重时呈“吊水”状,头朝上尾垂直向下悬浮,受到刺激时不停地快速旋转或不规则游动;鱼体腹部膨大,口腔、下颌、眼眶、鳃盖、肛门及鳍条基部等部位明显充血、出血,头顶正中部位皮下发红,头背部颅侧皮肤坏死、溃烂,病情严重的头骨裂开暴露出脑组织[26-27];解剖病鱼可见腹腔血水或透明腹水,脂肪组织、肝、肠、肾、体腔壁有点状或块状出血,肾脏、肝脏和脾脏肿大,脾脏深红色,肝脏色淡,肝、肾组织有白色坏死灶[31-32]。
2.2.2 微生物学方法
从感染发病及死亡鱼体中有规律地检测到纯一或优势的鮰爱德华菌,可判定为鮰爱德华菌病[3]。常从病(死)鱼的脑组织、肝脏等部位分离细菌接种于血液营养琼脂、脑心浸液琼脂或普通营养琼脂平板,在28℃培养约48 h,选取典型相应的菌落纯化培养后进行形态特征鉴定和生化特性检查[3]。该法是鉴定鮰爱德华菌的传统方法,耗时4~6 d,不利于及时准确诊断疾病,容易延误治疗时机。龚艳清等[33]采用基质辅助激光解吸/电离飞行时间质谱(matrix assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)技术可以快速、准确地检测和鉴定该菌,鮰爱德华菌与数据库中Edwardsiella ictaluri 885 EGS的匹配分值均在2.350~2.367之间,与EdwardsiellaictaluriDSM13697 HAM的匹配分值均在2.046~2.100之间。该方法在检测时间、重复性、稳定性、准确性等方面的总体表现都优于传统鉴定方法。
2.2.3 免疫学方法
目前检测鮰爱德华菌的免疫学方法有间接免疫荧光检测(indirect immunoinfluore-scence assay,IFA)、酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)和细菌凝集法等。有学者[34-35]制备了鮰爱德华菌的羊多克隆抗体和鲶鱼抗血清,利用免疫印迹试验,证明了鮰爱德华菌的12 kDa、18 kDa、30 kDa、34 kDa、37 kDa、60 kDa和70 kDa等7种蛋白具有强抗原性。基于此,李强等[36-37]利用从发病黄颡鱼中分离的鮰爱德华菌A86菌株为抗原,制备了6株抗鮰爱德华菌的单克隆抗体,建立了间接ELISA、竞争ELISA和免疫荧光法用于快速检测该菌。其中间接ELISA采用37℃过夜包被方法,能有效促进酶标板对细菌的吸附作用,病原菌检测灵敏度为5×106cells·mL-1;竞争ELISA中包被抗原5×108cells·mL-1,抗体稀释倍数为1∶80,抗体和竞争抗原比例为3∶7,标准曲线相关系数为0.990 1,此方法特异性强,最低检出限106cells·mL-1。李强等[38]还建立了能快速检测鮰爱德华菌的胶体金免疫层析试纸条,灵敏度可达5×106cells·mL-1,10 min内即可完成相关检测,并且不需特殊仪器,结果肉眼就可判读,适合非专业人员在基层现场使用,实用性强。
2.2.4 分子生物学方法
随着分子生物学检测技术不断发展,在该菌鉴定中可使用16S rRNA的基因序列分析[39],但此方法只能将该细菌鉴定到爱德华菌属,不能鉴定到种,因为鮰爱德华菌与迟缓爱德华菌的16S-23S rRNA区间基因序列有99%的相似率[40],因此需要几种方法结合进行鉴定才更准确。潘延乐[41]等建立了针对鮰爱德华菌外膜微孔蛋白N基因的PCR快速检测方法,最小核酸检出量为9.35×10-3μg·μL-1。刘礼辉等[42]建立了多重聚合酶链式反应(polymerase chain reaction,PCR)方法,可从鮰爱德华菌扩增出450 bp的目的片段,可检测出200 CFU·mL-1的鮰爱德华菌,对临床样本的检出率为100%。隗黎丽等[43]建立的鮰爱德华菌荧光定量PCR检测方法,灵敏度为10-5μg·μL-1。
3 鮰爱德华菌病防治方法
在实际养殖生产中,对鮰爱德华菌病的防治主要采取以防为主、防治结合的综合防治措施。
3.1 预防方法
3.1.1 综合预防
首先引进鱼苗和鱼种时要严格实施检验检疫,避免将带病苗种投入池塘;其次要从优化水质环境[44]、保持适宜的养殖密度、科学饲喂入手,采取综合预防措施,提高鱼类免疫力;同时日常饲养管理中要操作仔细、减少应激,水温较高时,不要拉网作业,不要运输鱼种。从源头上预防或减少鮰爱德华菌病发生[45]。
3.1.2 免疫预防
采取疫苗免疫方式预防鱼类感染鮰爱德华菌。针对该菌的鱼类疫苗目前主要有菌蜕疫苗、灭活疫苗、微球疫苗、减毒疫苗等。王荣华等[46-47]通过诱导表达制备了鮰爱德华菌菌蜕疫苗(Edwardsiellaictalurighost,EIG),相对免疫保护率达到89.3%。隗黎丽等[48]利用从患病黄颡鱼脑部组织分离出的致病菌株JXHS制备了黄颡鱼鮰爱德华氏菌的灭活疫苗,对黄颡鱼的免疫保护率达到70.2%。王荣华等[49]给斑点叉尾鮰腹腔注射福尔马林灭活的鮰爱德华菌,免疫保护率为64.3%。柳昭君等[50]采用灭活的鮰爱德华菌免疫蛋鸡,通过微包膜及高速离心喷雾干燥技术制备抗鮰爱德华菌的特异性IgY功能性蛋粉,采用泼洒和口服方式,对黄颡鱼免疫保护率分别为85.5%和70.0%。阳磊[51]制备了二联口服疫苗,采用低、中、高剂量获得鮰爱德华菌免疫保护率分别是75.0%、67.9%和60.7%。TRAN等[52]制备了2种鮰爱德华菌WZZE基因突变减毒疫苗WZM-L3(WZZE基因的1 038 bp全部敲除)和WZM-S3(WZZE基因缺失245 bp),2种疫苗对越南鲶鱼的免疫保护率(relative percent survival,RPS)分别为90.00%和89.29%。
3.2 治疗方法
在养殖生产中不提倡较多地用药,但一旦发现患病的鱼较多或病情较重时,则要及时施药治疗。有学者通过药敏试验确定了鮰爱德华菌敏感的药物有中药和多种药物联合组方。药敏试验表明,中草药中黄芩的抑菌作用最强,最低抑菌浓度(minimum inhibitory concentration,MIC)和最低杀菌浓度分别为3.75 mg·mL-1和7.50 mg·mL-1,连翘、大黄、蒲公英、金银花和黄柏有较强的抑菌作用,最低抑菌浓度为7.5~15.0 mg·mL-1[53];对抗菌先锋高度敏感,对伯乐立康、菌必清、菌毒康和海鱼安中度敏感,菌必清+抗菌先锋的联合抗菌效果最佳[54-56]。怀疑为鮰爱德华菌病时,应尽快对病原菌进行分离鉴定,并进行体外药敏试验,筛选出敏感药物进行治疗。选择治疗药物时要在水产养殖准许使用的药物内进行选择,另外在发病期间,全池泼洒稳定性二氧化氯(0.3 mg·L-1)或强氯精(0.4 mg·L-1)或漂白粉(1.0 mg·L-1)会有一定治疗效果[47]。

表2 鮰爱德华菌疫苗种类Tab.2 Varieties of Edwardsiella ictaluri vaccines

表3 鮰爱德华菌敏感药物Tab.3 The sensitive drugs of Edwardsiella ictaluri
4 结语
近年来,中国水产养殖业迅猛发展,部分从业者为追求养殖产量,过度增加养殖密度,忽视了疾病防控,导致养殖鱼类鮰爱德华菌病的发生率日渐增多,随之而来的药物滥用、药物残留等现象屡见不鲜,对水产养殖产品带来严重的质量安全隐患。因此加强对鮰爱德华菌病原的研究,如何从源头上预防、及时检测、准确诊断、对症治疗显得尤为重要。
鮰爱德华菌是对水产养殖有极大危害的病原菌,国内外学者对该菌的致病因子、侵染方式以及对鮰爱德华菌病的治疗开展了大量研究,建立了多种微生物学、免疫学及分子生物学检测手段。在养殖生产中除了采取综合防控措施外,目前发现可用菌蜕疫苗、灭活疫苗、微球疫苗、减毒疫苗等免疫疫苗预防该病发生,一旦发病检测出该病原,可使用水产准许的药物对症进行治疗,同时在治疗用药过程中要注意用药量与休药期等问题。抗菌药物使用不当,可使细菌产生耐药性,在水产养殖中滥用抗生素现象较普遍,致使耐药菌株大量出现,细菌对药物的抗性现在也越来越强,用药量应根据药效实验决定[53-57]。
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

