论文:鲤春病毒血症病毒的研究进展
鲤春病毒血症病毒的研究进展
林婧楠,赵景壮,卢彤岩,徐黎明
(1.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070;2.上海海洋大学水产与生命学院,上海 201306)
鲤春病毒血症病毒属单股负链RNA病毒目,弹状病毒科Rhabdoriridae,暂定为水泡性病毒属Vesiculorius,被类脂囊膜包裹的弹状病毒[1]。鲤春病毒血症的潜伏期较短,没有典型的外部临床症状,容易误诊。目前尚无有效控制该病的方法,一旦出现疑似该病的症状,应及早确诊,隔离感染和带毒的病鱼,截断水平传播途径及捕杀来控制。
1 病原生物学特征
CSVV病毒粒子在15%~60%的蔗糖溶液中浮力密度为1.16g/mL[2,3],在5%~25%的蔗糖梯度中沉降系数为38~40S[4]。外界环境的改变影响病毒的感染性,对酸(在pH3时30min,侵染率1%)、碱(在pH11时,侵染率50%~70%,pH7~10时最为稳定)、热(56℃,30min)、脂溶剂以及乙醚最为敏感,其他化学试剂,如2%NaOH、500mg/L含氯消毒剂、0.01%碘,在特定浓度和作用时间可使病毒失活,可用于养殖消毒。血清可以保护病毒的侵染力,实验室常用2%血清培养液保护病毒。含有血清时,经过4次反复冻融,侵染率在90%左右,而缺乏血清时,侵染率仅为5%左右。冷冻真空干燥可长期保存病毒[5]。
2 基因结构特征
CSVV粒子为典型的弹状结构,一端圆弧形,另一端平坦,长90~180nm,宽60~90nm[5-7]。其基因组全长为 11 019bp[8],由非翻译前导(Leader)区、基因区、基因间连接区及非转录拖尾(Trailer)区4个主要部分构成(图1)。
基因前导区有69bp,前19bp可能为启动子,其中50~56bp(GAAAAAT)为前导RNA转录终止信号,60~64bp(AACAG)为N基因转录起始信号。
基因区共包含5个开放阅读框(ORFs),编码5种结构蛋白:核蛋白(Nuclear protein,N)、磷蛋白(Phosphoprotein,P)、基质蛋白(Matrixprotein,M)、糖蛋白(Glycoprotein,G)和 RNA 聚合酶(RNA polymerase,L),3’端到 5’端的排列顺序为 N-P-M-G-L。
核蛋白(N)在病毒粒子中含量最多,主要与RNA紧密结合构成直径约50nm、呈螺旋对称的核衣壳。该结构蛋白在转录调节中起重要的作用[6]。
磷蛋白(P)为核衣壳的组成部分,呈酸性,纯化后SVCV的P蛋白在SDS-PAGE中分子量约50kD,高于推算的结果(35.5kD),其原因可能是P蛋白N端(45~88)存在一个大的负电荷结构域[8]。
基质蛋白(M)由223个氨基酸组成,呈磷酸化、高度碱性,构成囊膜内表面。糖蛋白通过M蛋白与螺旋状核衣壳相连,共同实现病毒粒子的装配、出芽的启动功能。
糖蛋白(G)由509个氨基酸构成,病毒粒子的囊膜表面有长钉状的糖蛋白突起。成熟的糖蛋白为三聚体囊膜粒子,由3部分构成:胞外结构域、跨膜结构域和胞浆结构域,是典型的跨膜蛋白,能选择性地识别宿主细胞受体,促使二者的膜融合,介导病毒内吞,使宿主细胞感染致病;在免疫系统下,识别病原,诱导宿主产生中和抗体。糖蛋白含有与免疫相关的抗原决定簇,对血清学特征起决定性作用,是当前DNA疫苗设计研究的热点。2002年至2004年,刘荭等[9]从养殖的鲤科鱼类和观赏鱼中分离出8株CSVV,测定了其G蛋白编码的基因序列,发现我国的这8个分离株与USA株、980451株、980528株和970469株在系统发育树上的进化方向一致。根据Stone等[10]对各地分离出的部分CSVV的G蛋白基因序列以及Basic等[11]1994年至2007年收集的22株G蛋白部分核酸序列的分析和系统发育树比较,将CSVV的基因型分成Ia、Ib、Ic和Id 4个亚组,Ia和Id的变异度较高,又将有明显差别的3个Id基因组毒株划分为Id1、Id2及Id3。CSVV中的一个血清型能与狗鱼苗弹状病毒(Pike fry rhabdovirus,PFRV)产生交叉反应。前期研究发现,中国CSVV的分离株的基因型为Ia[12]。
RNA聚合酶(L)是核衣壳的组成成分,可与N、P蛋白共同组成病毒内核衣壳的RNA蛋白复合物,完成病毒的转录和复制。
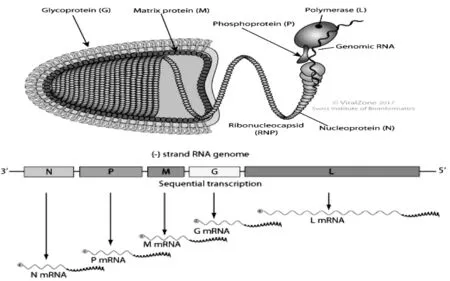
图1 鲤春病毒血症病毒(carp spring virernia virus,CSVV)病毒结构、基因组结构以及连接顺序(引自http://viralzone.expasy.org/4657)Fig.1 Structure,genomic and linkage of carp spring virernia virus(CSVV)
在基因间连接区的G-L基因中存在4bp(CTAT)保守序列,其余基因间存在2bp(CT)保守序列[13]。该调控区存在于水泡病毒属中;G-L基因间不存在类似粒弹状病毒属编码的非结构蛋白(nonstructural protein,NVprotein)基因。该蛋白在病毒复制过程中起重要作用,这两点均为区分粒弹状病毒属和水泡性病毒属的重要标志。
拖尾区有49bp,其中TATG(A)7为L基因转录终止信号,末端的8个核苷酸序列(GTCTTCGT)与前导区末端(ACGAAGAC)呈反向互补,是弹状病毒基因组及不分段负链RNA病毒的共同特征[8]。
与同属的其他弹状病毒相比,CSVV的蛋白序列中L蛋白间的同一性最高,与VSV的L蛋白氨基酸序列同一性达53.6%[14];与水疱性口炎病毒(Vesicular Stomatitis Virus,VSV)的M蛋白同一性达28%,在羧基末端的同一性较低[15]。
3 分类特征
迄今已报道的鱼类弹状病毒(Fish rhabdovirus)有十几种,鲤春病毒血症病毒(CSVV)是其中的一种,此外还包括病毒性出血败血症病毒(Viral haemorrhagic septicemia virus,VHSV)、传染性造血器官坏死病毒 (Infectious hematopoietic necrosis virus,IHNV)、日本牙鲆弹状病毒(Hirame rhabdovirus,HIRRV)、狗鱼苗弹状病毒、乌鳢弹状病毒(Snakehead rhabdovirus,SHRV)、弹状病毒 903/87(Rhabdovirus 903/87,903/87)、鳜弹状病毒(Mandarin fish Siniperca chuatsi rhabdovirus,SCRV)、胭脂鱼弹状病毒(Chinese sucker rhabdovirus,CSRV)及新近分离出的海鲑弹状病毒28/97(Sea trout rhabdovirus 28/97,STRV28/97)等[16-19]。
弹状病毒科包括水泡性病毒属(Vesiculovirus)、狂犬病毒属(Lyssavirus)、暂时热病毒属(Ephemerovirus)和粒弹状病毒属(诺拉弹状病毒属,Novirhabdovirus)。其中粒弹状病毒属是国际病毒分类委员会第7次报告上设立的一个新属。根据是否含有编码非结构蛋白的基因,将传染性造血器官坏死病毒、病毒性出血败血症病毒(viral haemorrhagic septicemia virus,VHSV)、鳢弹状病毒、牙鲆弹状病毒归为粒弹状病毒属。而鲤春病毒血症病毒和狗鱼苗弹状病毒暂定为水泡性病毒。
4 流行情况
鲤春病毒血症病毒感染的鱼类较为广泛,主要感染鲤科鱼类,如锦鲤Cyprinus carpio、草鱼Cten opharyngodm idellus、鲫 Carassius auratus、鲢 Hypophthalmichthys molitrix、鳙 Aristichthys nobilis、金鱼 Carassius auratus、拟鲤 Rutilus rutilus、圆腹雅罗鱼Leuciscus idus和丁鲷Tinca tinca等。此外,自然感染的鱼类还有六须鲇Silurus glanis[20]。一龄以上的鲤最易感染患病。在中世纪,该病在欧洲开始流行,对欧洲各国鲤科鱼类养殖业造成了巨大的经济损失[21],而后向美洲和亚洲等地传播。我国于2003年首次在天津养殖场的观赏鱼中分离出SVCV[22]。目前,该病已成为全球性鱼类的疾病。
该病毒可在13~22℃下生长,最适为17℃。因此,SVC常在水温15~20℃的春季爆发,17℃左右发病率高,水温超过20℃有所下降,超过22℃不再发病。
染毒鱼、病鱼和病死鱼是主要的传染源,以水平传播为主,垂直传播次之。水平传播包括直接接触传播和间接传播,间接传播包括非生物媒介(水);生物媒介(水生吸血寄生虫)以及污物传播。病毒随附着污物(粪便、尿液、皮肤黏液和性腺分泌液等)排出体外,4~10℃时水中和泥中仍具有感染性,可保持4~6周[5,23],可通过鳃进入鱼体内,在血液中保持11周左右。
5 临床症状及病理变化
5.1 临床症状
行为变化:早期病鱼呼吸困难,需氧量高,常聚集在池塘进水口附近,食欲减退,行动迟缓,对应激的反应迟钝,身体平衡力降低;后期病鱼萎靡,身体倾斜,常卧于池底[21,24],严重时停止游动。
临床症状:病鱼体表发黑、眼球突起、鳃丝苍白、皮肤表面和肌肉有出血点、腹部肿胀、内有积水,肛门处拖有一细长、黏稠、粪便样的肠黏膜炎症产物与排泄物的混合产物,常称之为“假粪”,但不属于该病的特征性症状。
5.2 病理变化
染毒鱼最终因体内水盐平衡失调致死。剖检病鱼发现,主要以全身性出血、水肿为主要特征症状。病毒通常在毛细血管内皮细胞、造血组织和肾元细胞等部位增殖。在感染期,肝、肾、脾、鳃、脑髓病毒含量较高,常作为检验组织,发病3周后,含量迅速下降消失。血液中病毒滴度不高,但持续时间长。肝脏实质组织出现多个病灶坏死、充血,可见黄疸现象;胰脏组织出现炎症以及大量坏死病灶;脾脏充血,网状内皮大量增生;肠道严重发炎,出现卡他性肠炎。
6 检测技术
CSVV病毒可在鲤上皮瘤细胞(EPC)、草鱼性腺细胞(CO)、鳙尾柄细胞株(FHM)、蓝鳃太阳鱼成纤维细胞(Lepomis macrochirus,BF-2)和虹鳟性腺细胞(RTG-2)等鱼类细胞株上增殖,造成细胞病变效应(Cytopathogenic effect,CPE)。病变细胞内出现颗粒,H&E染色可见胞质萎缩空泡化,核膜增厚,显微镜下可见脱落的细胞变亮[20]。FHM和EPC细胞最敏感,为OIE推荐的分离病毒的细胞。EPC和FHM的最适温度为20~25℃和20~22℃,产生的最大感染性为109TCID50/mL。该病毒除了在鱼类细胞中增殖,还能在禽类、哺乳类和两栖类动物细胞内增殖。
6.1 传统的检测方法及免疫学方法
目前,国内外常采用细胞培养法分离、检测CSVV病毒,再通过中和试验确定。该方法虽然准确率高,但检测大约需要2周左右,耗时费力。
在细胞培养分离病毒的基础上,可采用免疫学的方法,如酶联免疫吸附检验(Enzyme-linked immunosorbent assay,ELISA)进行鉴定、间接荧光抗体试 验 (Indirect fluorescent antibody test,IFAT),但CSVV的囊膜来自宿主的细胞膜,易产生非特异性的抗体,因而病毒的抗血清效价不高,影响检测结果[25]。CSVV在血清学上区别于其他弹状病毒,采用ELISA可能会与其他鱼类弹状病毒如VHSV、IHNV等发生交叉反应,还与PFRV有共同的抗原决定簇,在ELISA和间接荧光(IF)中有明显的交叉反应[26,27]。高隆英等[26]根据CSVV糖蛋白基因序列设计逆转录-聚合酶链式反应(RT-PCR)和半嵌套PCR(semi-nested-PCR)的引物 F1、R2、R4,其中 F1和R2可扩增出CSVV核酸中的714bp片段,F1和R4可扩增出606bp片段。特异性检测结果表明,与VHSV、IHNV和PFRV无交叉反应,具有良好的特异性,可在42h内得到结果。
6.2 OIE检测标准
根据OIE公布的《水产动物检测手册》,目前我国出入境检验检疫行业标准SN/T1152-2002以及我国规定的GB/T 15805.5-2008鱼类检疫方法,常规检测CSVV方法是通过细胞培养分离病毒后,采用RT-PCR方法进行诊断。该过程需经过两代的细胞培养,时间长,检测效率低。王姝等[28]在国家行业标准的基础上,有机结合细胞培养法,利用酶联免疫吸附试验ELISA进行初步的筛选,再用RT-PCR复查,即实现高通量检测,整个用时又比国家标准用时缩短了一半。
6.3 核酸探针检测方法
Svetlana F等[29]根据CSVV-S30株的M和G基因的核酸序列设计引物,构建生物素标记的核酸探针,应用RT-PCR和斑点杂交技术成功在感染CSVV的细胞培养液和鱼组织中检测出病原体,其中在脑组织中最易检测出该病毒。利用生物素标记的核酸探针方法,既实现了快速检测,又提高了其灵敏度。
6.4 荧光RT-PCR检测方法
张利峰等[30]根据鲤春病毒血症病毒的核酸保守区序列,建立了快速检测CSVV的荧光RT-PCR检测技术,仅需4h就可以检测出10-6病毒稀释液,不仅试验周期短、灵敏,还实现了对病毒模版RNA的定量。安伟等[31]根据CSVV的核蛋白的保守序列,成功建立了SYBR Green I荧光定量RT-PCR检测技术,病毒检测下限100.76TCID50/mL,灵敏度高于常规PCR 100倍。
6.5 数字RT-PCR检测方法
吴斌等[32]利用“油包水”的形式,对RT-PCR的扩增反应进行计数,建立了数字RT-PCR的技术。与实时定量RT-PCR相比,在两者均能检测病毒的104稀释倍数基础上,拥有更高的灵敏度。
6.6 间接ELISA检测方法
郭闯等[33]以超速离心法纯化CSVV,免疫大白兔,制备了兔抗CSVV免疫血清,同时利用间接ELISA方法快速检测CSVV,以兔抗SVCV血清1∶300稀释后包被96孔酶标板,滴度筛查CSVV阳性毒株,结果与RT-PCR鉴定结果相同。整个过程需要1 d,具有周期短、准确的优点。
6.7 新型液相芯片检测技术
尹伟力等[34]根据GenBank中CSVV的G基因序列,找出25对保守碱基作为检测探针,设计引物并进行生物素标记,通过液相芯片仪器检测偶联荧光编码微球与CSVV的RT-PCR产物杂交反应产生的荧光信号,发现液相芯片检测体系在鉴别CSVV上具有高特异性和灵敏度,最低检出量为10 pg。
6.8 环介导等温扩增技术(Loop-mediated isothermalamplification,LAMP)
Shivappa等[35]对美国卡罗莱纳州分离的CSVV菌株的G蛋白基因序列,设计出4套引物,分别进行LAMP和RT-LAMP扩增,证实建立的RT-LAMP对CSVV的检测具有特异性,与RT-PCR的灵敏度相似,最低检测量达101TCID50/mL。
陈进会等[36]依照G基因保守序列,设计3套LAMP引物,通过恒温实时荧光检测系统ESE-Quant tube scanner,第1套和第3套有峰值,进而引入环引物。结果显示,第1套LAMP引物的检测稳定性、灵敏度和特异性效果最佳,能够实现高效检测CSVV。因此,实时荧光LAMP法具有极佳的灵敏度和快速检验的优势,适用于基层检验,检测限度可达到每反应2.4 pg。
7 防治方法
目前对于该病没有特效药和有效的控制方法,只能通过化学、物理消毒的方式预防该病。一旦发现该病,应及时中断传染源,隔离或扑杀病鱼和带毒鱼,防止大规模疫病的爆发[31]。在20世纪80年代,欧洲出现了含CSVV和PFRV的二阶灭活疫苗,能够诱导鲤科鱼类产生高效的中和抗体。随后,成功开发了CSVV弱毒疫苗,在养殖渔业中有良好的应用前景。给体质量40~100g的鲤腹腔注射6.3×104TCID50后,免疫保护率在90%以上[37]。我国的CSVV疫苗研制还处于探索阶段,主要的研究领域集中在减毒疫苗、亚单位疫苗及核酸疫苗等。
传统灭活疫苗、减毒疫苗具有毒力返强的缺点[25],需要添加佐剂,存在一定的安全隐患,应用效果不稳定。
DNA疫苗是90年代的最新一代疫苗,无需像传统的灭活疫苗添加佐剂,却仍具备传统疫苗的优点。DNA疫苗构型更接近天然构象,潜在致病性低,适于工厂化集中生产,相对安全,具有一定的应用价值[38]。CSVV疫苗的研发有一定的进展,Kanellos等[39]以CSVV G蛋白基因,设计了构建稳定性较好的DNA疫苗。为评估已构建的4组CSVV糖蛋白DNA疫苗的免疫效果,欧阳征亮等[40]通过肌肉注射的免疫途径诱导机体产生免疫。结果显示:第一组重组质粒DNA编码全长的G蛋白疫苗保护率为14.47%;第二组重组质粒DNA编码去C端信号肽的G蛋白疫苗保护率为22.22%;第三组重组质粒DNA编码去N端跨膜区的G蛋白疫苗保护率为17.32%;重组质粒DNA编码同时去C端信号肽和N端跨膜区的G蛋白疫苗保护率为17.32%。Emmenegger等[41]的鲤攻毒试验验证,已构建的CSVV的G蛋白DNA疫苗的保护效率为50%~88%,能够有效降低感染鲤的死亡率。
8 展望
鲤春病毒血症是一种高致病性、高死亡率的鲤科鱼类传染性疾病。目前,对该病毒的疫苗研制尚处于探索阶段。尽管SVC的DNA疫苗已取得一定的进步,但是在DNA疫苗的效率优化、安全性以及疫苗的免疫途径上仍然存在一些问题。同时,DNA疫苗的作用及代谢机制还有待进一步探索[37]。
声明:本站属公益性没有商业目的的网站,上列文章仅供个人学习参考。本站所发布文章为原创的均标注作者或来源,未经授权不得转载,许可转载的请注明出处。本站所载文章除原创外均来源于网络,如有未注明出处或标注错误或侵犯了您的合法权益,请及时联系我们!
欢迎关注本站(可搜索)"养鱼E线"微信公众帐号和微信视频号"养鱼一线"以及头条号"水花鱼@渔人刘文俊"!

