鱼类新品种(系)生长性能测试工作探讨

中国自1990年开始成为世界第一水产养殖业大国,2020年水产养殖产量为5 224.2×104t,占全球养殖产量的近一半,其中鱼类养殖产量为2 761.36×104t,占养殖总产量的52.86%[1]。鱼肉为低热量、低脂肪、高蛋白食物,富含多种必需氨基酸、不饱和脂肪酸、矿物质、维生素及人体必需的微量元素,营养价值高,成为满足我国人民高品质的物质生活需要的重要食物蛋白源。鱼类增养殖业在产生经济效益的同时,还能为改善水域环境生态服务,如通过草鱼吃杂草、鲢鳙摄食浮游动植物等起到固碳作用,在物质能量循环及碳中和中发挥较为重要的生态功能,因而越来越受到人们的关注。
水产种业被誉为渔业的“芯片”,是国家农业战略性、基础性核心产业的组成部分。多年来,党中央都将农业种子资源调查、保护、开发和利用列入“三农”工作的重点,2022年初,中央一号文件重点部署了全面推进种业振兴实施方案,农业农村部下发《农业农村部关于开展全国农业种质资源普查的通知》(农种发〔2021〕1号)等文件,将我国农业种业工作提到了前所未有的高度。各级渔业行政主管部门、相关高校科研院(所、站)积极行动,调动多方力量逐步摸清家底,组建繁育(育种)中心,建立种质资源库,推进渔业育种工作向纵深发展。随着水产种业振兴工作的渐次推进,新品种(系)创新体系的日益发展,对优选出的海淡水新品种(系)在试验中如何更好地开展测试,评价其生长性状等方面提出了新的挑战,建立系统、科学的新品种(系)评价体系应放在更加突出的位置。农业农村部已发布了《水产新品种生长性能测试鱼类》(SC/T 1142—2019)技术标准[2],但是考虑到海、淡水鱼类品种的多样性、养殖测试环境的复杂性、测试人员素质的差异性、无意或有意操作造成的人为“偏差”等主、客观因素的存在,现存技术标准还难以完全涵盖鱼类新品种(系)生长性能测试的现实需要。科学客观、公平公正地反映鱼类选育单位(企业)培育的新品种(系)生长性能的优良特征,对苗种选育(生产)单位和养殖应用单位来说都极为重要。本文围绕保证鱼类新品种(系)生长性能测试技术的公平、公正性开展初步探讨,提出规范我国鱼类养殖新品种(系)的生长性能的测试技术要求,以期为相关高校、科研院所(站)、企业等在建设测试场所、制定操作规范、开展测试试验及其结果评价时提供技术参考。
1 我国鱼类主要养殖种类和新品种认定及测试技术现状
1.1 主要水产养殖鱼类的种类结构及其产量
我国鱼类常见的主要养殖种类有青鱼(Mylopharyngodonpiceus)、草鱼(Ctenopharyngodonidella)、鲢(Hypophthalmichthysmolitrix)、鳙(Aristichthysnobilis)、鲤(Cyprinuscarpio)、鲫(Carassiusauratus)、鳊(Parabramispekinensis)、罗非鱼(Oreochromisspp)、鳜(Sinipercachuatsi)、大黄鱼(Larimichthyscrocea)、石斑鱼(Centropristisspp)、鲈(Percafluviatilis)、鲆(Bothidae;Citharidae;lefteye flounders) 等上百种(表1、表2),种类繁多且涵盖草食(草鱼等)、杂食(鲤等)、肉食性鱼类(鳜、大黄鱼等),在食物链中的生态位层次齐全。同时,我国地域辽阔,环境多样,品种之间也存在一定的长速差异、品质优劣、耐受力不同和区域特色等,为鱼类新品种(系)的选育提供了良好的基础条件。

表1 2020年中国淡水鱼类养殖主要种类及其产量(部分)
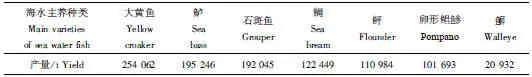
表2 2020年中国海水鱼类养殖主要种类及其产量(部分)
1.2 我国水产养殖鱼类新品种认定情况
1996—2021年,农业农村(农业)部审定并公布的水产新品种有237个,其中鱼类新品种有120个。在淡水鱼类中,罗非鱼、鲤、鲫、鳜的新品种占大部分;海水新品种中石斑鱼、大菱鲆(Scophthalmusmaximus)、牙鲆(Paralichthysolivaceus)占多数(表3)。就鱼类新品种(系)的选育而言,生长快意味着商品鱼的养成时间缩短,养殖综合效益提升,更容易受到养殖生产者的欢迎。因此,生长性状指标仍是考量选育出的新品种(系)的价值性的重点选项之一。我国公布的鱼类新品种中多以提高生长速度为目标。
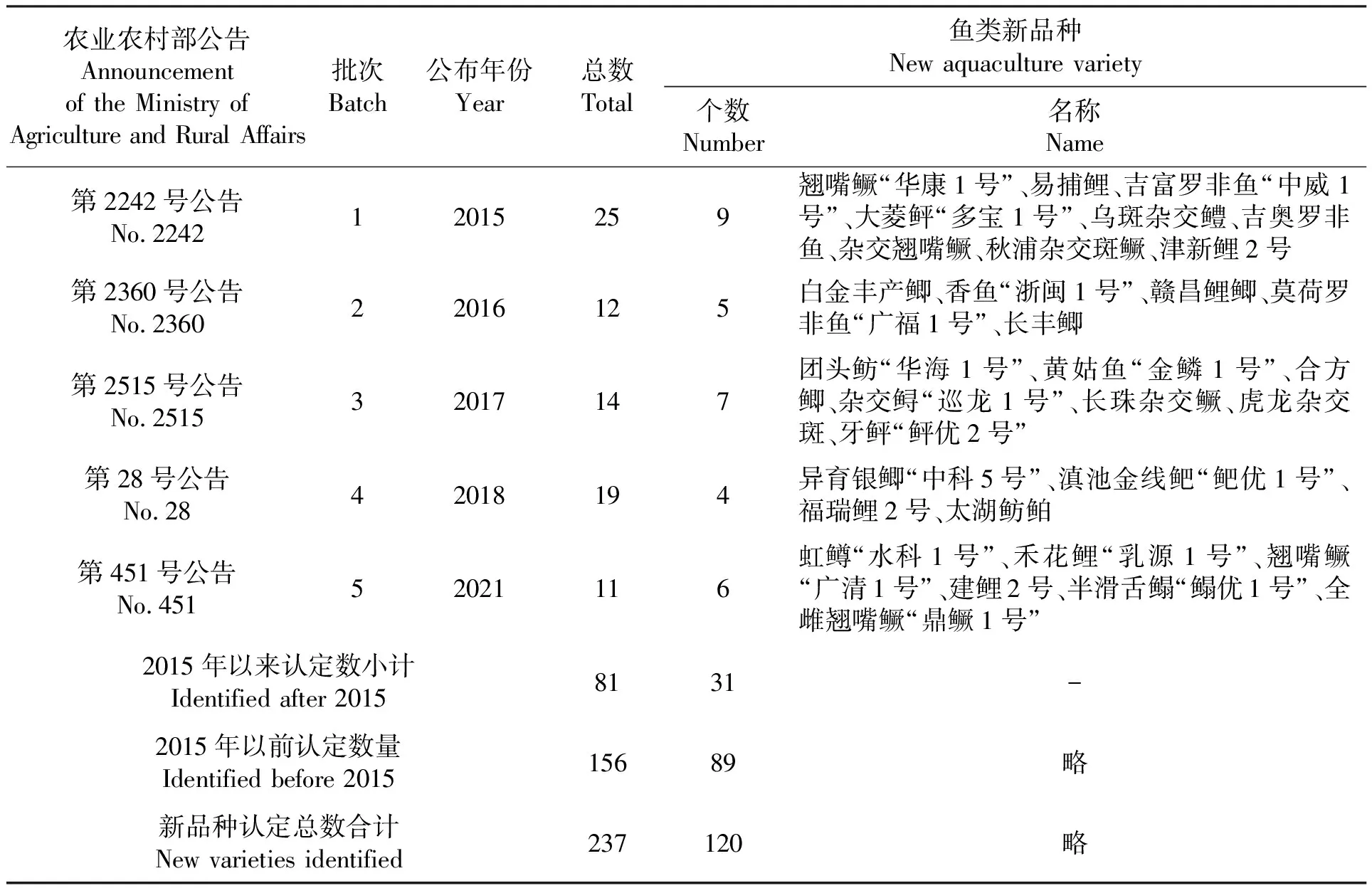
表3 1996年以来及近5批次我国水产养殖新品种(系)认定情况
1.3 鱼类新品种(系)性能测试技术规范
截至目前,农业农村(农业)部已发布《水产新品种审定技术规范》(SC/T 1116—2012)[3]和《水产新品种生长性能测试鱼类》(SC/T 1142—2019)技术标准[2]。前者就水产新品种审定的基本条件、数量条件、表型特征和性能指标等方面提出了相应的规范性要求;后者就测试的品种要求、测试方法、计算方法、结果描述等方面作出了相应的规范性要求,尤其在室内和室外测试场地平台、池塘及网箱建设、测试组数、鱼种个体及群体数量和质量、测试周期、技术操作规范、养殖管理、初始及最终数据采集、结果描述及评判等方面[2]。这些标准为我国进一步开展水产养殖新品种(系)的审定、认定工作起了很好的指导作用。但我国地域辽阔,东西、南北跨度大,在鱼类品种的特点、适应性要求、养殖环境的温度和盐度、水域状况、水环境质量、食物丰度及养殖管理活动等方面存在差异,海水品种(系)的差异性体现得尤为突出,该标准难以涵盖全部内容。因此,在开展水产新品种(系)生长性能测试时,应针对测试品种(系)的测试场所的建设、种苗的选定、养殖模式的设定、养殖环境参数的确定,以及营养与饲喂技术、管理的操作规范和数据采集标准(减少人为干扰)等方面,制定相应的相对统一的科学、详细、规范、可操作性强的要求。
2 影响鱼类新品种(系)生长性状测试评价的主要因素
养殖鱼类生长主要受遗传、养殖环境、养殖活动等三个方面影响:1)遗传因素是鱼类生长调控的内因,对生长的影响表现出因果效应的关系[4]。2)养殖环境是影响鱼类生长性状调控的外因,一般呈现出剂量效应。基因和养殖环境在实际生产中还存在相互作用的影响,主要来自于鱼类基因型对不同环境条件的适应性情况,具有特异性和复杂性的特点,相关研究还相对有限,结论尚不明确[4-5]。3)养殖活动是生产过程中施加于鱼类的“人为”影响因素,包括养殖模式、放养密度、所用饲料及操作管理等,它是影响鱼类生长的重要因素,贯穿鱼类养殖生产的全过程,伴随环境因子共同对鱼类生长产生影响。
2.1 基因对鱼类生长性能测试的影响
基因对鱼类的生长发育起到至关重要的作用,其生长性状是由一系列复杂而多样的基因共同调控的,但相关的调控机理仍有待进一步地厘清。研究显示,与鱼类生长轴密切相关的基因主要有生长激素基因(Growth hormone)、生长激素受体基因(Growth hormone receptor)、生长激素抑制激素基因(Growth hormone inhibiting hormone)、生长激素释放激素基因(Growth hormone releasing hormone)、胰岛素样生长因子基因(Insulin-like growth factor-Ⅰ和Insulin-like growth factor-Ⅱ)、胰岛素样生长因子受体(Insulin-like growth factor receptor)、胰岛素样生长因子结合蛋白(IGF binding protein)[6-8]、转化生长因子β(Transforming growth factor β)[9-10]、肌肉生长抑制素基因(Myostatin)[8,11-12]、生肌调节因子(Myogenic regulatory factors)[13-14]等。这些基因在鱼类生长、新陈代谢、营养积累、食欲控制、游动调节、免疫应答等方面参与调控鱼类的生理学过程。鱼类新品种(系)的选育通过杂交、定向选育、雌核发育、基因编辑等手段,改变选育鱼类的基因结构,以获得稳定的具有这些快速生长性状的群体为选育目标,实现培育生长速度较快的鱼类新品系(种)的目的。
2.2 养殖环境对鱼类生长性能测试的影响
鱼类的生长性能的体现与其养殖环境因子(如温度、溶解氧、流速、光照、pH值、氨氮、盐度等)密切相关。作为变温动物,鱼类的生存、新陈代谢与生活的水温关系密切,在适温范围内,鱼类的生长速度随着水温的升高而加快,水温的过高或过低均不利于鱼类的生长,甚至会引起胁迫导致其死亡[15-17]。鱼类生存需要水中溶解氧,在适宜范围内,鱼类的生长速度一般随着溶解氧的升高而加快,而过高可能产生“气泡病”,过低可导致生长减慢、饲料效率降低、有害物质升高、发生病害甚至死亡[18-20]。鱼体表面的侧线鳞可感知环境中的水流状态,在一定流速范围内,流速增加对鱼类生长产生积极的影响,而过高的流速则使养殖鱼类为对抗水流耗能增大,从而抑制鱼类的生长[21]。栖息水层不同的鱼类对光照的需求有所不同,随着生存水深的增加,鱼类生长对光照的需求下降,但强光对鱼类生长会有抑制作用[22-26]。鱼类生长的pH值范围多在6.5~8.5之间,过低或过高均会影响鱼类的生长[27]。水中的氨氮、亚硝基氮等物质对鱼类有毒害作用,过高会对鱼类生长产生显著的抑制作用,甚至致其死亡[28]。盐度胁迫可能造成鱼体内分泌等生理状态的紊乱,当这种胁迫加重或持续时间过长而超出了鱼体的内部调节能力和免疫应答应对能力时,会导致吸水、脱水等鱼体生理生化指标的变化,出现行为异常甚至死亡[29]。因此,环境因子影响着鱼类生长性能的表达,在一定范围内呈现剂量效应,其过量或不足均可能对鱼类生长产生显著影响,甚至发病、死亡。
2.3 养殖活动对鱼类生长性能测试的影响
根据养殖水域的不同,鱼类养殖主要有淡水养殖和海水养殖:淡水养殖模式以池塘、网箱养殖为主,湖泊养殖、水库养殖、河沟养殖为辅[30];海水养殖模式主要包括陆基(含池塘、工厂化循环水)养殖和网箱养殖[31],环境中的盐度等因子对鱼类生长性能的体现产生显著的影响。根据养殖模式的不同,鱼类的增养殖主要有池塘养殖(土池、集约化)[32]、海上网箱(普通网箱、深水大网箱)养殖[33]、工厂化循环水养殖[34]、大水面增殖(含海洋牧场)[35]等多种养殖形式。由于养殖方式的不同,放养密度、网箱或池塘结构、水环境质量、操作管理等差异明显,这些也成为影响鱼类生长性能的显著因子[3]。
2.3.1 养殖活动中放养密度差异的影响
放养密度是影响鱼类对养殖环境资源利用效率的重要因素,不同的养殖品种(系)由于基因型[36-38]、摄食(含天然食物)[39-40]、抗流能力[21]、抗应激能力和环境适应能力(耐受)[41]等方面存在差异而适应的养殖密度有所不同。鱼类在经过一段时间不适宜的密度胁迫后存在生长抑制,再恢复有利的生长条件后又存在补偿生长的现象[42]。大多品种(系)在低密度养殖时生长快,如尼罗罗非鱼幼鱼在拥挤环境下养殖3周,生长速度下降,随后恢复低密度环境下养殖12周,其生长速度加快[43];有的种类具有领地意识,如鲑科鱼类在低密度下存在攻击性,随着种群密度的升高会抑制领域行为[42]。在高密度养殖条件下,鱼类大多更易遭受饥饿胁迫,但处于饥饿胁迫的鱼类在恢复食物获取后也会产生补偿生长的现象[44],而有的种类具有集群性,适应一定程度的密集养殖,如俄罗斯鲟幼鱼在低密度养殖下因摄食不积极、活动范围过大、游动消耗能量增多等而导致鱼类生长受到抑制[45]。因此,在鱼类新品种(系)的选育和生长性能测试的过程中,应确保合理的放养密度,不因密度胁迫而对测试产生影响。
2.3.2 养殖活动中饲料(饵料)及饲喂差异的影响
养殖鱼类营养水平差异主要来源于饲料配比、加工方式、存储、饲喂条件的不同。饲料中的蛋白质含量、氨基酸组成、动物蛋白与植物蛋白比例[46-47]、脂肪含量、脂肪酸组成[48-49]、碳水化合物含量[50-51]、维生素[52-56]、矿物质[56]等微量元素均会显著影响鱼类的生长。在实施测试时,如果测试鱼类新品种(系)投喂的是鲜杂鱼糜,则难以把控营养成分的标准统一,所用饲料对测试组和对照组鱼类的生长性能的影响显著。由于原料采购、配方组成及配比、加工方式、存放和饲喂使用等原因,造成所用饲料某种成分的缺失、流失、转化或变性也难以避免,且完全符合测试鱼类新品种(系)的全价配合饲料在实际生产中也难实现,因此,饲喂饲料也可能会对新品种(系)生长性能测试产生干扰。另外,养殖过程投喂不均或鱼类个体间互相抢食,可能导致养殖鱼类遭受饥饿胁迫,虽恢复正常食物获取后也会获得补偿生长[44],但在鱼类新品种(系)生长性能测试的过程中,除了基于饲料方面的新品种(系)的选育,应尽可能做到饲喂饲料标准可控,不因其饲喂活动产生显著影响。
2.3.3 测试过程的人为或非主观可控因素的影响
在测试试验过程中,难免存在饲喂次数和数量等管理人员操作方面主观可控的人为因素的干扰,如半滑舌鳎存在因投饲不足而导致的营养胁迫后出现生长抑制和补偿生长的特点[57],人为控制投喂后产生的小规格半滑舌鳎与正常养殖的相同规格半滑舌鳎进行对比,测试结果将产生显著的偏移。因此,开展新品种(系)生长性能测试时应尽量减少有意或无意的干扰,科学、合理、规范地设计试验测试条件。同样地,测试中还会受到噪音(打雷或爆破等)、光强度(闪电等)、排换用水等周围环境的干扰,但无法完全隔绝此类非主观可控因素的影响。而这些影响因素对不同的鱼类品种(系)的影响程度也有所差异,如养殖环境噪音对大黄鱼等石首鱼科鱼类产生的影响程度较大[58];肉食性鱼类在投饲不足时常常发生自相残杀的现象而影响成活率[59];甚至在开放水域中的不同网箱由于布局的差异造成箱内水流速度不同,对测试鱼类造成的影响也不尽相同[21]。
3 建立科学的测试试验设计及评价体系探讨
按照所选育品种(系)的特色或特异性要求,建立科学、公正、统一的测试平台,完善符合要求的养殖水环境条件、营养条件、养殖技术措施等,减少人为的操作干扰或应激等,开展科学的数据采集、数理统计、结果评价和判定,才能对所选品种(系)作出科学公正的结果描述和评判,真正得出所测试鱼类品种(系)因“基因存在差异”而产生的生长性能的优劣表现。
3.1 生长性能测试基地建设要求
影响鱼类生长性能的因子主要包括遗传、生长环境和养殖活动等人为干扰。鱼类新品种(系)优选的生长性能的表现可以是多方面的,如适应耐低温或耐高温、耐低溶解氧或耐高溶解氧、耐低盐或耐高盐的鱼类,适应土池养殖、密集养殖的鱼类,适应低动物蛋白的肉食性鱼类,延长或缩短性成熟年龄的鱼类等。因此,按照《水产新品种生长性能测试鱼类》(SC/T 1142—2019)技术标准,建立鱼类新品种(系)室内、室外测试单元室时,建议设有若干室内单一影响因子为变量的测试设施和室外自然环境下的测试场所;配套完整、数量足够的养殖和测试设备且环境条件可控的室内测试平台;网箱或池塘结构、数量、面积、水深等技术参数[2]可支持池塘、工厂化循环水池塘、网箱(大、小)等养殖模式的技术测试。在测试过程中应能满足养殖的需要,以及对测试组数、养殖尾数等测试结果进行数理统计的需要,即室内和室外测试平台均至少应满足测试组、对照组的最低测试组数(各3组)及养殖尾数(每组100尾以上)的要求,考虑到测试时间应在90 d以上[2],测试中又难免会出现病害或死亡等损失,因此建议测试组数、养殖尾数均可适当增加。
3.2 生长性能测试环境建设要求
鱼类养殖的环境因素与生长性能的表现密切相关,这些因素包括:1)水温,高温或低温的耐受、水温突变耐受;2)盐度,高盐或低盐耐受、盐度突变耐受;3)溶解氧,高溶解氧或低溶解氧耐受、溶解氧突变耐受;4)酸碱度,高酸碱度或低酸碱度耐受、酸碱度突变耐受;5)氨氮(亚硝酸盐、硫化氢、农药)等有毒有害物质耐受或突变耐受;6)性成熟积温差异;7)悬浮物(SS)、藻相及耐受;8)流速,高流速耐受;9)钙、镁离子等成分及占比要求、耐受等。在设计测试环境时,除了对鱼类新品种(系)有特殊的测试要求外,对鱼类生长性能差异的测试试验建议将环境影响降低到最小,不因养殖环境而对新品种(系)生长性能的测试产生显著影响。例如,对于鱼类品种(系)耐低温或耐高温、耐低溶解氧或耐高溶解氧、耐低盐或耐高盐等上述养殖环境的适应性生长测试,建议建立单一影响因子或综合影响因子为变量的测试养殖场所、平台,先在环境可控的室内测试平台进行相关测试,结合环境难以控制甚至不可控的室外池塘或网箱中养殖测试后进行综合评判。为了加快鱼类新品种(系)生长性能的测试进程,建议测试场与选育单位沟通(非盲样测试),了解所选品种(系)的选育方向、品种(系)特点,有针对性地开展其生长性能测试的对比,测试组和对照组的布局需确保科学性和随机性,除要求的测试因子外的溶解氧等其他因子均应相同或控制在较适宜的范围内,不应使这些因子的差异对鱼类的生长产生干扰。
3.3 测试条件的建立和技术参数确定
根据鱼类新品种(系)选育生产单位提供的养殖技术经验来编制该品种(系)的测试试验方案、技术参数[2],如新品种(系)的耐高温或耐低温、耐高溶解氧或耐低溶解氧、耐应激、高饲料转化率,适合土池养殖、高密度养殖等生长性能特点均可作为技术参数,并为之建立相关的测试条件、操作手册。比如,对耐高温或耐低温的新品种(系)测试,测试组和对照组所选用的鱼类均要求足组足量、无伤无病、体质健壮、体色体表正常、年龄相同、平均规格无显著差异,建议在室内场地中暂养稳定后再转入测试专用设施开展单因子耐受测试,建立科学的增幅或降幅梯度耐受测试标准(规范)操作手册;而对反映综合生长性状的室外测试,建议对所选用鱼类(测试组和对照组)先进行暂养过渡2~3 d后,再平均分配、转移到准备好的各测试箱或池中进行综合生长性能测试。
3.4 测试饲料的选用与饲喂技术要求
养殖过程中所用饲料中的蛋白质含量与质量[60]、脂肪含量与质量[61]以及人工饲喂技术下的摄食水平[62]等对鱼类生长产生显著影响。因此,在进行鱼类新品种(系)生长性能的测试时,除了对营养方面的鱼类生长性能的测试应按照测试要求提供相应的饲料外,对其他方面的测试建议使用产品质量稳定可靠的饲料厂家所生产的营养全面的优质饲料,设计科学的投饲表,按照相同且最适的饲喂方法进行科学投喂。维生素[63]、微生态制剂[64]可改善鱼类免疫功能、提高抗病能力,可对试验结果产生影响,建议先对其进行评估后再确定添加或不添加。测试开始时,各测试组和对照组的群体数量、体质量差异不显著,因此采取的饲喂量、次数、时间等因素均需相同;此后,建议每周可按一定比例的增量进行饲喂量递增,并结合气候、水温、摄食状况等进行调整。对残饵进行收集、去除(烘干至饲料中的水分含量)并记录。如同池或同箱中出现个体分化较大的情况,建议采用“先大后小”的投喂方式,即先投喂大颗粒料喂饱大规格的鱼,再投喂小颗粒料喂饱小规格的鱼,并适当延长投喂时间,以保证饲喂效果;同样为确保转料(摄食不同粒径规格的饲料)顺利,转料时也可采取“先大后小”的饲喂方式。
3.5 测试过程的养殖管理与病害防控要求
根据鱼类新品种(系)选育生产单位提供的该品种(系)特征、养殖技术经验等共同制定其测试操作规范[2],涉及内容建议包括测试组和对照组的测试组数、鱼种数量和质量要求,标志标识标记及检测技术要求,暂养容器及其管理要求,苗种选择、处理与投放技术要求,饲料营养与饲喂技术要求,水质调控技术要求,病害防治技术要求,防止人为干扰措施要求,养殖生产记录与档案建设要求,抽采样与收获技术要求,数据采集与测定技术要求,结果收集与评价技术要求,项目终止要求,档案建设要求等操作规范。建议在测试过程中采取基本一致的养殖管理措施,从试验设计、选苗、用料、管水、操作、防病、收获、数据采集、效果评价、项目暂停与终止等要求相一致。为尽量减少鱼类应激反应,在投放、打样、收获、称重、测定时均可采用丁香酚等先行麻醉后再进行操作。为了减少人为的管理操作差异,建议测试单位对测试组和对照组(其他优良品种或传统品种)分别用微卫星分子标记标识后[65],无规格、数量显著差异的同池或同箱开展混养,然后再进行统一的养殖管理,这种测试方式得到的数据将更加科学,结果评判将更加公正。
3.6 测试数据的采集、结果评价与判定要求
为了鱼类新品种(系)生长性能测试评价的结果更加公正,应建立抽采样、数据采集的测定技术公平、公正性措施体系[2],建议至少应包括:1)在测试期间,设置“测试试验的终止条件”,对综合生长性能的测试期间(非单因子的耐受测定)测试组内所有原因导致的死亡或者总死亡率作为试验的主要终点,任何试验条件都不能以增加总死亡率为代价,超过此临界值时,试验停止。亦可设置非正常死亡率或发病率作为终点终止时间,终点时间临界值建议可参照统计学上的显著性差异(5%)来设定,可随观察或者不同研究目的而有所变化。2)测试全过程中,应减少人为干扰测试试验的技术措施,包括对测试组和对照组进行随机采抽样、数据采集等,按要求确定观察、计数、称重、测量、检测等操作的前后次序,对测试过程中的死亡个体也作相应的数据采集。3)测试组或对照组的有效组数均应超过3组,每组不少于100尾,且测试品种和对照品种的个体数量至少1 000尾[2],测试试验才能认定为有效,其获得的数据和测定的结果才可进行评价判定,否则测试试验终止,需重新开展。4)如果测试组与对照组组数不同(均超过3组)时,建议对组数多的一边(测试组或对照组)先进行随机舍去,使得测试组和对照组的组数保持数量相同,再按照《水产新品种生长性能测试 鱼类》(SC/T 1142—2019)技术标准[2]进行数据采集、结果测定等。5)测试组或对照组中的鱼类存在病鱼(如出现病灶增重等),建议病鱼不应作为采集对象进行增重计算,但可作为计算养殖成活率、结果描述的内容。6)将得到的各组数据采用《水产新品种生长性能测试 鱼类》(SC/T 1142—2019)技术标准[2]进行计算、数理统计与结果评价。
综上所述,开展鱼类品种(系)生长性能测试工作应具备以下条件:1)应有暂养场地(室内和室外),可将所有鱼种(测试组和对照组)先放入其中进行适应性过渡。2)有一定数量、面积、水深等条件符合要求的室内测试场所,如养殖系统[2],配备完整的设施设备,以“水族箱”单元室的循环水养殖系统为佳。3)有一定数量的室外土池、网箱养殖测试场地,设置与布局符合鱼类生长测试的科学性要求,配套完善、运转正常的设施设备。4)配有数据采集的计数、测量、称重、测定(包括水质指标)、饲料存放与投喂、病害分析与检测、捕获、运输、标志标识、冷冻冷藏、微卫星分子标记检测等较为完整的设备及工具。5)应有一定数量的熟练技术人员、管理人员和操作工人,测试过程中的人为干扰无显著影响,档案建设完整,数据采集准确,能做到评价客观和可追溯。
科学、规范、公正地进行鱼类品种(系)生长性能测试和评价,对于开展鱼类新品种(系)研究、开发、推广工作极为关键。通过循环水、土池或网箱的室内和室外的单养对比,结合微卫星分子标记的混养测试试验,以减少环境、人为操作等“非可控”因素造成的影响,真正反映鱼类基因表达的本身生长性能特征。本文可为今后开展鱼类品种(系)生长性能测试试验工作提供补充和参考,也可为其他品种(系)的测试工作提供很好的借鉴。
声明:本站未注明出处的转载文章是出于传递更多信息之目的。若有未注明出处或标注错误或侵犯了您的合法权益,请与本网站联系,我们将及时更正、删除,谢谢!
欢迎关注本站(可搜索)"养鱼第一线"微信公众帐号和微信视频号"养鱼第一线刘文俊视频号"以及头条号"水花鱼@渔人刘文俊",将会定期向你推送信息!

